酸碱中和滴定的详细过程解析(酸碱中和滴定)
学习目标
1.了解酸碱中和滴定的原理,知道酸碱中和滴定中溶液 pH 的变化是判断滴定终点的依据, 了解指示剂的选择方法。
2.知道酸碱中和滴定的主要仪器及用途,掌握酸碱中和滴定的实验操作、数据处理、误差分 析及其在定量测定中的迁移应用。
知识导学
知识点 1 酸碱中和滴定实验
1.概念和原理
(1)概念 依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法。
(2)原理 在中和反应中,酸提供的 H +与碱提供的即:c(H + )·V 酸=c(OH - )·V 碱,则 c(H + )= cOH - ·V 碱 V 酸 或 c(OH - )= cH + ·V 酸 V 碱
2.主要仪器使用
(1)仪器:滴定管,铁架台,滴定管夹,锥形瓶,烧杯。

仪器 a 是酸式滴定管,仪器 b 是碱式滴定管。精密度:0.01ml
(2)滴定管的使用方法
①检查仪器:使用前先检查滴定管活塞是否漏水。
②润洗仪器:在加入溶液之前,洁净的滴定管要用所要盛装的溶液润洗 2~3 遍。
③加入溶液:分别将溶液加入到相应滴定管中,使液面位于滴定管 0 刻度线以上。
④调节起始读数:在滴定管下放一烧杯,调节活塞,使滴定管尖嘴部分充满溶液,然后调节 滴定管液面使其处于“0”刻度或“0”刻度以下的某一刻度。准确读取数值并记录。
3.主要试剂
(1)待测液;
(2)标准液;
(3)指示剂(一般用酚酞或甲基橙,一般不用石蕊,颜色改变不明显)。
4.指示剂的选择
(1)原理:由曲线可以看出,在酸、碱中和滴定过程中,溶液的 pH 在接近滴定终点时有一个 突变过程,在此范围内,滴加很少的酸(或碱),溶液的 pH 就有很大的变化,能使指示剂的 颜色变化明显,所以即使酚酞、甲基橙的变色不在恰好中和的 pH=7 的点上,但体积差距很 小,可以忽略不计。

图:0.100 0 mol·L -1 NaOH 溶液滴定 20.00 mL 0.100 0 mol·L -1 HCl 溶液的滴定曲线。
(2)酸碱指示剂法(只能测定溶液的 pH 范围) 常见酸碱指示剂的变色范围:

特别提醒 若滴定终点为碱性时,选择酚酞,酸性时,选择甲基橙,中性时,酚酞、甲基橙 都行,一般不选择石蕊,变色现象不明显
5.滴定操作

特别提醒
①滴速:先快后慢,当接近终点时,应一滴一摇,甚至半滴一摇,利用锥形瓶内 壁承接尖嘴处悬挂的半滴溶液。
②终点的判断:滴入最后一滴标准液,指示剂变色,且在半分钟内不变回原色,视为滴定终 点。
6.数据处理 为减少实验误差,重复实验 2~3 次,求出所用标准溶液体积的平均值,然后再计算待测液 的物质的量浓度。
例 1.用 0.01 mol·L -1硫酸滴定 0.01 mol·L -1 NaOH 溶液,中和后加水至 100 mL。若滴定时 终点判断有误差:①多加了 1 滴硫酸;②少加了 1 滴硫酸(设 1 滴为 0.05 mL)。则①和②中 pH 相差________。
例 2.用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量 8.2 g 含有少量中性易溶杂质的样品,配成 500 mL 待测溶液。称量时,样品可 放在________(填字母)称量。 A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用 0.200 0 mol·L -1的盐酸来滴定待测溶液,不可选用________(填字母)作指示剂。 A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视______________________;在铁架台上垫一张白纸,其目的是 ____________________________。
知识点 2 中和滴定误差分析
1.分析依据 c 待测·V 待测=c 标准·V 标准 c 待测= c 标准·V 标准 V 待测 c 标准、V 待测均为代入定值,误差均体现在 V 标准的大小
2.常见的误差分析 以用标准盐酸滴定待测氢氧化钠溶液为例:

例 1.称取一定质量的 NaOH 来测定未知浓度的盐酸时(NaOH 放在锥形瓶内,盐酸放在滴定 管中)。用 A.偏高;B.偏低;C.无影响;D.无法判断,填写下列各项操作会给实验造成的误 差。
(1)称量固体 NaOH 时,未调节天平的零点( )
(2)将 NaOH 放入锥形瓶中加水溶解时,加入水的体积不准确( )
(3)滴定管装入盐酸前未用盐酸润洗( )
(4)开始滴定时,滴定管尖端处有气泡,滴定完毕气泡排出( )
(5)滴定前未将液面调至刻度线“0”或“0”以下,结束时初读数按 0 计算( )
(6)在滴定过程中活塞处漏液( )
(7)摇动锥形瓶时,因用力过猛,使少量溶液溅出( )
(8)滴定前读数时仰视,滴定完毕读数时俯视( )
例 2.在化学实验操作中,往往由于读数不规范导致较大的实验误差。下列有关实验中,会 导致所配制(或所测定)溶液浓度偏高的是(其他操作均正确)( )
A.配制 500 mL 1 mol·L -1稀硫酸实验中,用量筒量取 18 mol·L -1浓硫酸时俯视读数 B.配制 100 mL 5 mol·L -1氯化钠溶液实验中,定容时仰视刻度线
C.用标准盐酸滴定待测 NaOH 溶液实验中,使用碱式滴定管开始平视,后来俯视读数
D.用标准 NaOH 溶液滴定待测盐酸实验中,使用碱式滴定管开始平视,后来俯视读数
归纳总结
滴定管读数误差分析
滴定管正确的读数方法是视线、刻度线、凹液面最低点在同一水平线上。试分析下列图示读 数对滴定结果的影响:

(1)如图Ⅰ,开始仰视读数,滴定完毕俯视读数,滴定结果会偏小。
(2)如图Ⅱ,开始俯视读数,滴定完毕仰视读数,滴定结果会偏大。
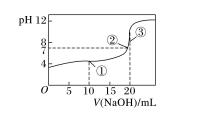
知识点 3 酸碱中和反应过程中的图像分析
酸碱中和过程中的图像纵坐标为 pH,横坐标为酸或碱溶液的体积。
1.分析步骤
(1)横纵坐标:分清加入的酸溶液或碱溶液;
(2)起点 pH:结合题目信息得出酸(或碱)的强弱;
(3)滴定终点或 pH=7 的点:利用盐类水解、弱电解质电离平衡、水的电离等知识分析出对 应的体积;
(4)其他特殊点分析:滴定一半或滴定过量等点相关问题。
2.实例
以用 0.100 0 mol·L -1 NaOH 溶液滴定 20.00 mL 0.100 0 mol·L -1 HA 溶液为例,其滴定曲线如 图。

3.其他图像 (1)分布系数 分布系数:组分的平衡浓度占总浓度的分数
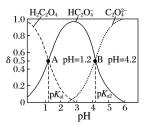

(2)对数图 pOH—pH 曲线:pOH=-lg c(OH)

①表示一元酸与一元碱中和过程中 H +与 OH -离子浓度的关系。
②Q 点代表中性。
③M 点显酸性,N 点显碱性,两点水的电离程度相同。
例 1.298 K 时,向 20.0 mL 0.10 mol·L -1 H2A 溶液中滴加 0.10 mol·L -1 NaOH 溶液,滴定曲 线如图所示。下列说法正确的是( )

A.该滴定过程应该选择石蕊溶液作指示剂
B.W 点到 X 点发生的主要反应的离子方程式为 H2A+2OH -===A2-+2H2O
C.Y 点对应的溶液中 c(Na+ )+c(H + )=c(OH - )+2c(A2- )
D.反应 H2A+A2- 2HA -的平衡常数 K=1.0×10 7.4
例 2.常温下,用浓度为 0.100 0 mol·L -1的 NaOH 溶液分别逐滴加入到 20.00 mL 0.100 0 mol·L - 1的 HX、HY 溶液中,pH 随 NaOH 溶液体积的变化如图。下列说法正确的是()

A.V(NaOH)=0 mL 时,两份溶液中,c(X - )>c(Y - )
B.V(NaOH)=10.00 mL 时,c(X - )>c(Na+ )>c(HX)>c(H + )>c(OH - )
C.V(NaOH)=20.00 mL 时,c(OH - )>c(H + )>c(Na+ )>c(X - )
D.pH=7 时,两份溶液中,c(X - )=c(Na+ )=c(Y - )
未完,有需要的朋友。私信免费送哦
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






