初中化学最基础的三个化学知识(中学教师也必须要知道的化学常识)
化学好教师
现代仪器
1. 核磁共振仪:有机物中处于不同化学环境的氢原子种类;
2. 红外光谱仪:主要测定有机物中官能团的种类;
3. 紫外光谱仪:有机物中的共轭结构(主要指苯环);
4. 质谱仪:有机物的相对分子质量,对测定结构也有一定的帮助;
5. 原子吸收(发射)光谱仪:测定物质的的金属元素,也可测定非金属元素;
6. 分光光度计:测定溶液中物质的成分以含量,重点是测反应速率;
7. 色谱分析仪:利用不同物质在固定相和流动相中分配比的不同,对物质进行分离,主要分类物理性质和化学性质相近的物质,纸层析就是其中的一种;
8. 李比希燃烧法:测定有机物中C、H、O、N、Cl的有无及含量,CO2、H2O、N2、HCl;
9. 铜丝燃烧法:测定有机物中是否含卤素,火焰为绿色说明含有卤素;
10. 钠熔法:测定有机物是否含有X、N、S,NaX、Na2S、NaCN;
3. 多糖:
①淀粉(C6H10O5)n和纤维素(C6H10O5)n,n值是一个区间,故两者不是同分异构体,都是混合物;
②判断淀粉水解程度的方法 (在酸性条件下水解)
a.尚未水解:必须先加NaOH中和硫酸,再加入新制氢氧化铜加热,无砖红色沉淀;
b.完全水解:加入碘水,不呈蓝色
c.取两份,一份加入碘水呈蓝色;一份加入NaoH中中和硫酸后,再加入新制氢氧化铜加热,有砖红色沉淀
③人体中无纤维素酶,不能消化纤维素,多吃含纤维素食物可促进肠道蠕动;
氨基酸和蛋白质
1. α-氨基酸:氨基和羧基连在同一个碳上
天然蛋白质水解生成的氨基酸都是.α-氨基酸;
2. 两性:-NH2具有碱性,-COOH具有酸性
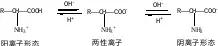
固体氨基酸主要以内盐形式存在,所以具有较高的熔沸点,且难溶于有机溶剂;
两个不同的氨基酸缩合形成二肽,有四种不同的产物(两个自身,两个交叉);
3. 分离:当氨基酸以两性离子存在于溶液中时,其溶解度最小,而不同的氨基酸出现这种情况的pH各不相同,故可利用此差异,通过调节溶液的pH值来分离氨基酸;
4. 盐析:许多蛋白质在水中有一定的溶解度,溶于水形成胶体;
在浓度较高的低盐金属盐(Na2SO4)或铵盐中,能破坏胶体结构而使蛋白质溶解度降低,从而使蛋白质变成沉淀析出,析出的蛋白质仍具有生物活性;
5. 变质:
①重金属盐、强酸、强碱、甲醛、酒精等可使蛋白质变性而失去活性,析出的蛋白质不再溶于水;
②当人体误食重金属盐时,可喝大量的牛奶、豆奶、鸡蛋清来解毒;
③酒精消毒是破坏了病毒的蛋白质活性而杀死病毒;
6. 颜色反应:
①蛋白质遇双缩脲试剂呈玫瑰紫色;
②含苯环的蛋白质与浓硝酸作用生成黄色物质;
③氨基酸遇茚三酮呈紫色;
7. 氢键存在:
①蛋白质的二级结构;
②DNA双螺旋结构,AT之间两条,CG之间三条;
油 脂
1. 油脂不是高分子,是由高级脂肪酸与甘油形成的酯类;
2. 油:不饱和脂肪酸甘油酯,常温液态,如豆油、花生油;能使溴水退色;不能从溴水中萃取溴单质;
3. 脂肪:饱和脂肪酸甘油酯,常温固态,如猪油、牛油油;
4. 皂化反应:油脂与碱反应生成甘油与高级脂肪酸钠;
5. 油脂硬化:不饱和高级脂肪酸甘油酯与氢气反应生成饱和高级脂肪酸甘油酯
6. 油脂和矿物油不是同一物质,矿物油是烃类;
7. 天然的油脂都是混合物;
8. 硬水中有较多的Mg2 、Ca2 ,会生成不溶于水的(C17H35COO)2Mg和(C17H35COO)2Ca,使肥皂的消耗量增加,故不宜在硬水中使用肥皂;
9. 不饱和脂肪酸甘油酯中的双键会被空气氧化而变质;
10. 地沟油和人造奶油都是油脂;
化学中的不一定
1. 原子核不一定都是由质子和中子构成的。如氢的同位素(11H)中只有一个质子。
2. 酸性氧化物不一定都是非金属氧化物。如Mn2O7是HMnO4的酸酐,是金属氧化物。
3. 非金属氧化物不一定都是酸性氧化物。如CO、NO都不能与碱反应,是不成盐氧化物。
4. 金属氧化物不一定都是碱性氧化物。如Mn2O7是酸性氧化物,Al2O3是两性氧化物。
5. 电离出的阳离子都是氢离子的不一定是酸。如苯酚电离出的阳离子都是氢离子,属酚类,不属于酸。
6. 由同种元素组成的物质不一定是单质。如金刚石与石墨均由碳元素组成,二者混合所得的物质是混合物;由同种元素组成的纯净物是单质。
7. 晶体中含有阳离子不一定含有阴离子。如金属晶体中含有金属阳离子和自由电子,而无阴离子。
8. 有单质参加或生成的化学反应不一定是氧化还原反应。如金刚石→石墨,同素异形体间的转化因反应前后均为单质,元素的化合价没有变化,是非氧化还原反应。
9. 离子化合物中不一定含有金属离子。如NH4Cl属于离子化合物,其中不含金属离子。
10. 与水反应生成酸的氧化物不一定是酸酐,与水反应生成碱的氧化物不一定是碱性氧化物。如NO2能与水反应生成酸—硝酸,但不是硝酸的酸酐,硝酸的酸酐是N2O5,Na2O2能与水反应生成碱—NaOH,但它不属于碱性氧化物,是过氧化物。
11. pH=7的溶液不一定是中性溶液。只有在常温时水的离子积是1×10-14,此时pH=7的溶液才是中性。
12. 用pH试纸测溶液的pH时,试纸用蒸馏水湿润,测得溶液的pH不一定有误差。
13. 分子晶体中不一定含有共价键。如稀有气体在固态时均为分子晶体,不含共价键。
14. 能使品红溶液褪色的气体不一定是SO2,如Cl2、O3均能使品红溶液褪色。
15. 金属阳离子被还原不一定得到金属单质。如Fe3 可被还原为Fe2 。
16. 某元素由化合态变为游离态时,该元素不一定被还原。如2H2O=2H2↑+O2↑,氢元素被还原而氧元素被氧化。
17. 强氧化物与强还原剂不一定能发生氧化还原反应。如浓硫酸是常见的强氧化剂,氢气是常见的还原剂,但可用浓硫酸干燥氢气,因二者不发生反应。
18. 放热反应在常温下不一定很容易发生,吸热反应在常温下不一定不能发生。如碳与氧气的反应为放热反应,但须点燃;Ba(OH)2·8H2O与NH4Cl反应为吸热反应,但在常温下很容易发生。
19. 含金属元素的离子不一定都是阳离子。如AlO2-、MnO4-。
20. 最外层电子数大于4的元素不一定是非金属元素。如周期表中ⅣA、ⅤA、ⅥA中的金属元素最外层电子数均多于4个。
21. 不能在强酸性溶液中大量存在的离子,不一定能在强碱性溶液中大量存在。如HCO3-、HS-等离子既不能在强酸性溶液中大量存在,也不能在强碱性溶液中大量存在。
22. 组成和结构相似的物质,相对分子质量越大,熔沸点不一定越高。一般情况下该结论是正确的,但因H2O、HF、NH3等分子间能形成氢键,熔沸点均比同主族元素的氢化物高。
23. 只由非金属元素组成的晶体不一定属于分子晶体。如NH4Cl属于离子晶体。
24. 只含有极性键的分子不一定是极性分子。如CCl4、CO2等都是含有极性键的非极性分子。
25. 铁与强氧化性酸反应不一定生成三价铁的化合物。铁与浓硫酸、硝酸等反应,若铁过量则生成亚铁离子。
26. 强电解质不一定导电;一般强电解质的晶体不导电;
27. 强电解质的导电性不一定强于弱电解质;与溶度有关;
28. 失去电子难的原子获得电子的能力不一定强。如稀有气体原子既不易失去电子也不易得到电子。
常考知识点的归纳
1. 主要成分是纤维素的物质
麻类、棉花、木棉、人造丝、人造毛、人造棉、铜氨纤维等;
干扰项:光导纤维、醋酸纤维、硝化纤维、火棉、胶棉;
2. 属于蛋白质的物质,水解得到氨基酸,燃烧有焦羽毛气味
动物毛发角蹄、蚕丝、血红蛋白、酶类、天然皮革;
干扰项:人造奶油;
3. 主要成分为油脂的物质
动物油、植物油、地沟油、人造奶油、鱼肝油、脂肪;
干扰项:矿物油;
4. 高分子物质
蛋白质、淀粉、纤维素、PVC、PLA、核酸、聚XX;
干扰项:油脂、维生素;
5. 能水解,且产物均为葡萄糖的物质
淀粉、麦芽糖、纤维二糖、纤维素;
6. 元素定性分析法
李比希燃烧法、钠熔法、铜丝燃烧法、元素分析仪、原子吸收(发射)光谱;
7. 测定有机物结构有作用
核磁共振、质谱、红外光谱
8. 原子结构模型的建立
①汤姆生:在阴极射线实验基础上提出“葡萄干面包式”模型;
②卢瑟福:在α粒子散射实验基础上提出“核 电子”模型;
③波尔:在量子力学基础上提出轨道模型;
干扰项:道尔顿:只是提出了原子的概念;
布朗运动:只能说明分子作无规则运动;
概 念
1. 电解质:在水溶液中或熔融状态下能够导电的化合物;
水、有机酸、无机酸、碱、盐、金属氧化物都是电解质
2. 非电解质:在水溶液中和熔融状态下都不能够导电的化合物;
3. 强电解质:在水溶液或熔融状态下完全电离的电解质;
强酸:HCl,H2SO4,HNO3,HI,HBr,HClO4等
强碱:KOH,NaOH,Ca(OH)2,Ba(OH)2等可溶性碱
绝大部分盐:CaCl2,CuSO4,Na2CO3,BaSO4,CaCO3等
干扰项:难溶性盐虽然溶解度小,但它是强电解质;
4. 弱电解质:在水溶液或熔融状态下部分电离的电解质;
弱酸:HAc,H2CO3,HF,HClO,H2SO3,H2S,H3PO4等;
弱碱:NH3H2O,Cu(OH)2Mg(OH)2等难溶性碱;
少部分盐:Pb(Ac)2,HgCl2
5. 碱性氧化物:能与酸反应,只生成盐和水的氧化物;
6. 酸性氧化物:能与碱反应,只生成盐和水的氧化物
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






