关于化学键的对话(千奇百怪的化学键)
化学家发现一些原子以令人惊讶的方式结合在一起,完全偏离了传统化学键的定义。
翻开任何一本化学教科书,你都会发现,其中少不了对化学键的介绍。这是不用奇怪的。化学是一门研究化学反应的学科,而化学反应的本质是化学键的断裂和生成。所以,化学键可谓化学作为一门独立学科的“立命之本”。
化学键是原子的最外层电子通过转移或共享而形成的“纽带”;就好比一对夫妻通过婚姻组成一个家庭,通过这个纽带,它们彼此束缚在一起。可是令人惊讶的是,尽管距今化学键概念的提出已有一个半世纪了,但是我们对它远远没有彻底理解。譬如,传统的化学键只有离子键、共价键、金属键等几种类型;但是最近的发现表明,化学键的类型比我们想象的要多;而且一些熟悉的化学键可能与我们原先想象的不太一样;甚至有一些键,完全违背了化学键的正统观念,根本就不涉及电子。
这些新型的化学键不仅能让我们更好地了解现有的物质,而且还能帮助我们挖掘化学元素的潜力,为太阳能电池、药物、数据存储和更多其他应用提供一个全新的材料世界。
化学键简史
早在1860年代初,化学家们已经开始以短横线连接元素符号的格式来书写化学物质的名称。例如,H-H表示由两个氢原子组成的氢气分子H2。到1866年,英国化学家爱德华·弗兰克兰德发明了“键(bond)”这个术语,来描述由这些短横线所代表的关系。
那个时候,人们对原子是否真的存在都还有争议。谁也没去设想我们今天熟悉的这幅“一群核外电子围绕一个原子核运动”的原子图景。共价键的概念,即两个原子通过共享电子来成键的想法,是在20世纪初才被首次提出来的。直到1920年代,量子理论才告诉人们这种情况是怎么发生的:原子们总是倾向于寻求处于能量最低的状态,而共享电子可以使两个原子的集体能量低于它们单独时各自拥有的能量之和。
我们今天对化学键的理解主要归功于诺贝尔奖得主美国化学家莱纳斯·鲍林。除了解释了共价键的成因,鲍林还表明,在某些情况,电子从一个原子转移到另一个原子上,使前者带正电,后者带负电,两者以静电吸引的方式粘在一起,形成离子键。然后还有金属键:其中一些电子从它们的原子中分离出来,形成自由的“电子胶”,失去了外层电子的金属原子成为正离子,嵌镶在“电子胶”中,并依靠与这些电子的静电作用而相互结合。
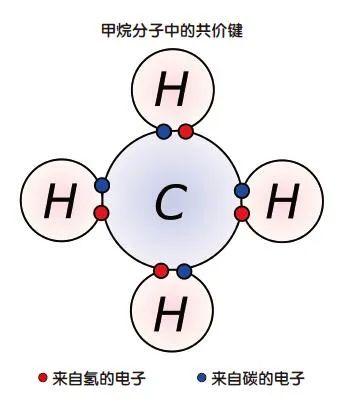
所有这些化学键要么共享电子,要么转移电子。但即使在那时,这种简单的分类也已经心余力绌。以范德瓦尔斯力为例。它可以使分子或原子相互粘连,但不会形成常规的化学键。范德瓦尔斯力帮助像氦气和氩气这样的惰性气体在非常低的温度下液化。有时它也足够强,可以将原子拴在一个集体中,例如两个氧分子(O2)通过范德瓦尔斯力形成一个O4原子团。但范德瓦尔斯力算不算化学键呢?没有人能给出一个明确的答案,因为对于化学键的含义,从来没有达成一个共识。
考虑到化学键的概念演化至今,越来越模糊不清,在本文中我们把凡是有助于分子、原子结合在一起的“纽带”,一律称为“化学键”。那么,下面要介绍的,就是除范德瓦尔斯力外的另四种另类“化学键”。
一、似驴似马的元价键
原子可以以局部的方式共享电子,如共价键;也可以以全体的方式共享电子,如金属键;但不可能同时兼两者吧。所以传统上,共价键和金属键被认为是不能兼容的。
但事情也许没那么简单。2019年,科学家发现一整类新材料,它们中的化学键似驴似马:既像共价键又像金属键。这类材料通常由来自金属和非金属交界处的类金属元素(如碲和锗)以及位于元素周期表金属区最右侧边缘的元素(如铅和锡)结合而成。这些元素结合成的键,每个都由两个电子组成(似共价键),然而这些电子又并非为单个分子所有,而为整块材料所共享(似金属键)。科学家称这种化学键为“元价键”,由此形成的化合物称为“初生金属”。

初生金属的性质也似驴似马。正常的金属既是热的良导体,又是电的良导体,而初生金属虽然是电的良导体,但导热性能却很差。更重要的是,其导电性能对环境温度特别敏感。这使得初生金属成为有用的热电材料,可用于收集废热,将其转化为电能。
二、幽灵氢键
事实上,早于范德瓦尔斯力,第一个被发现不合正规定义的化学键是氢键。
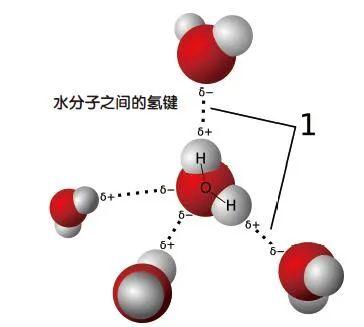
氢键涉及已与氧、氮或氟等原子形成共价键的氢原子。由于这些元素的原子倾向于独占那对共享电子,使氢带有轻微的正电荷,因此氢又可以吸引其他负极性的分子(这类分子虽然总电荷为零,但由于电荷分布不均匀,导致略微带负电)。分子通过氢的媒介结合在一起,所以叫“氢键”。但氢键通常比共价键、离子键要弱得多,而且也不是靠共享或转移电子而形成的,所以又不是严格意义上的化学键。
氢键的存在很普遍。水(H2O)在常温是液体而非气体,靠的是水分子之间的氢键;氨基酸的一条条分子链通过氢键形成复杂形状的蛋白;DNA双螺旋结构上的一对对碱基,通过氢键形成碱基对……
然而,人们仍然不完全清楚氢键是什么。作为氢键的一个简单模型,双氟化物离子(HF2-)通常被认为是一个共价键的氟化氢(HF)分子,通过氢键结合一个氟离子形成的,假如用-代表共价键,…代表氢键,其结构式即为F-H…F。但科学家后来发现,当双氟化物离子在水中振动时,其结构在F-H…F和F…H…F之间不断变化。换句话说,其中一个键总是在共价键和氢键之间切换。在这里,氢键和共价键的区别开始模糊了。
键通常不是刚性的,而是可以弯曲、拉伸和振动的。这表明,要确定一个键的存在,我们需要评估的不仅仅是原子是否粘在一起,还要看粘连了多长时间。一个典型例子是超临界水:水被加热到超过其临界点(在218个大气压,水的沸点是374℃),在那里不再有液态和气态之分。人们一直在争论这种时候是否还有氢键存在。最近有位德国化学家对此做了模拟。结果显示,超临界水中的氢键断裂得非常快。在这种情况下,是否还有资格成为氢键,只能各说各话了。
更好地了解超临界水中的氢键对化学工业有很大的帮助。超临界水可以溶解普通水不能溶解的东西,它是有毒的有机溶剂(如苯或甲苯)的环保替代品。
三、不涉及电子的机械键
把两个钥匙环扣在一起,它们也算“结合”成了一体。但这种“结合”不涉及任何作用力,仅仅是机械地串起来而已。
有机化学中也有环状的分子,如苯。它们也可以机械地串起来,在不涉及电子的情况下就能永久地连接。这样的结合被称为“机械键”。
用这种方式可以把环状和链状分子组装成纳米机器。例如,用轮烷类分子模仿车轮,用链烃类分子模仿车轴等,你可以像乐高玩具一样装配出纳米级别的机器。这些纳米机器可以被用作开关和转子,其潜在的应用包括分子信息存储,以及人工分子肌肉。2016年的诺贝尔化学奖颁给了在这个领域工作的三位化学家,以表彰他们在分子机器设计中的贡献。
迄今为止,这些分子机器大多是在溶液中各自为阵,现在的一个挑战是,如何让这些分子机器协同工作。例如,只有当许多这样的分子机器一起工作时,由它们组成的群体才会真正发挥作用。
四、不是由电子形成的化学键
迄今我们说的化学键,除了机械键,都涉及电子。那么,成键的能不能换成别的粒子呢?答案是肯定的。
电子有位胖表亲,叫μ介子。μ介子与电子具有相同的负电荷,但质量要大207倍,也可以将原子结合起来。μ子可以在粒子加速器中制造出来,并能将电子从原子中撞出去,取代电子的位置。这样,原先成键的地方就变成了μ键。但μ子不稳定,存在时间只有几分之一秒,所以μ键的寿命也很短。

这听起来似乎没什么用处。但由于μ子比电子要重得多,μ键的强度也会大得多,这将使分子中的两个原子核拉得更近。在一个通过μ键形成的H2分子中,两个氢原子核的距离是原来的1/196。研究人员一直试图利用这一效应,将两个氢原子核拉得足够近,以便它们能够发生聚变反应,释放出核能。
1957年,物理学家用氢的重同位素氘和氚,首次演示了这一设想。虽然演示成功,但遗憾的是,这样的核反应无法持续。“持续”的意思是一个反应完成之后,能立刻就启动另一个,类似原子弹的链式裂变反应。所以,要想通过这种方式开发核能,目前还无法实现。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com