高中化学酸碱中和滴定 高中化学各种酸碱中和滴定曲线图的认识与应用
近年高考频繁出现酸碱中和滴定的图象题,此类题试题综合性强,难度较大,不仅考查学生定性与定量结合分析问题的思想,而且考查学生数形结合识图用图的能力,还要求学生能深入微观世界认识各种化学过程来解决比较微粒浓度大小问题。
但万变不离其中,离不开指示剂的选择,离不开滴定曲线的认识与应用,离不开电离平衡、水解平衡与三守恒 ( 电荷守恒、物料守恒、质子守恒 ) 分析比较离子浓度大小等问题。
滴定曲线的认识与应用:酸碱中和滴定曲线图是以所滴入的酸或碱溶液的体积为横坐标、以中和反应后溶液的 pH 为纵坐标体现中和滴定过程的曲线图。
强酸与强碱互相滴定的曲线图,前半部分与后半部分形状变化不大,但中间突跃大 ( 即酸或碱溶液一滴之差,溶液 pH 变化大,出现突变 ) 。分析强酸与强碱互相滴定时的离子浓度大小,只要关注水的电离平衡即可,没有其它平衡影响。
A .盐酸的物质的量浓度为 1.0mol·L - 1
B . P 点时反应恰好完全,溶液呈中性
C .曲线 a 是盐酸滴定氢氧化钠的滴定曲线
D .酚酞不能用作本实验的指示剂
解析: 认识 滴定曲线 图是解题的关键,强酸与强碱 相互 滴定突跃大,且恰好中和时溶液 pH=7 ,故酚酞、甲基橙均可作指示剂。识图:滴定前 pH=1 , c (HCl)=0.1mol·L-1 , pH=13 , c (NaOH)=0.1mol·L-1 。
显然 a 曲线为 NaOH 溶液滴定盐酸的曲线,曲线 b 为盐酸滴定 NaOH 溶液的曲线, P 点表示盐酸与氢氧化钠恰好完全中和,溶液呈中性,唯 B 正确。
二、强酸滴定弱碱曲线图的应用
例2. ( 全国高考 I 卷 12)298K 时,在 20.0mL0.10mol·L - 1 氨水中滴入 0.10mol·L - 1 的盐酸,溶液的 pH 与所加盐酸的体积关系如图所示。已知 0.10 mol·L - 1 氨水的电离度为 1.32% ,下列有关叙述正确的是 ( )

A.该滴定过程应该选择酚酞作为指示剂
B . M 点对应的盐酸体积为 20.0mL
C . M 点处的溶液中 c (NH4 )=c(Cl - )=c(H )=c(OH - )
D . N 点处的溶液中 pH<12
解析: 强酸滴定弱碱的突跃小,且恰好中和时溶液处于弱酸性 ( 生成的强酸弱碱盐水解呈酸性 ) ,故盐酸滴定氨水时应选择酸性范围内变色的甲基橙为指示剂, A 错。
氨水与盐酸恰好完全反应生成的 NH4Cl 水解显弱酸性, pH<7 ,故 pH=7 的 M 点对应的盐酸体积应该小于 20.0mL , B 错。
由电荷守恒知, M 点溶液中 c (H )=c(OH - ) , c (NH4 )=c(Cl - ), 但 c (NH4 )=c(Cl - )≠c(H )= c(OH - ) ,故 C 错。 N 点是未滴定前的氨水, c (OH - )=0.10 mol·L-1×1.32%=1.32×10-3mol·L-1 , pH=11 lg1.32 <12 ,故 D 正确。
例3. 在常温下, 0.1000mol·L-1Na2CO3 溶液 25mL 用 0.1000mol·L-1 盐酸滴定,其滴定曲线如图所示。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是 ( )

① a 点: c (CO3 2 - )>c(HCO3 - )>c(OH - )
② b 点: 5c (Cl - )>4c(HCO3 - ) 4c(CO3 2 - )
③ c 点: c (OH - ) = c (H ) c (HCO3 - ) 2c (H2CO3)
④ d 点: c (H ) = 2c (CO3 2 - ) c (HCO3 - ) c (OH - )
A . ①② B . ②③ C . ③④ D . ②④
解析: 用 盐酸滴定 Na2CO3 溶液依次反应为:
HCl Na2CO3==NaHCO3 NaCl,HCl NaHCO3==H2CO3 NaCl。显然, a 、 b 、 c 点盐酸不足,均按第一个反应进行, d 点二者恰好完全反应,按两个反应进行。 a 点滴入12.5mL盐酸反应后得到等量Na2CO3和NaHCO3的混合溶液,因CO3 2 - 水解程度大于HCO3 - ,故有 c (CO3 2 - )<<i>c (HCO 3 - ),①错。
b 点滴入20mL盐酸反应后得到NaHCO3、NaCl、Na2CO3的混合溶液,HCl与Na2CO3的物质的量之比为4∶5,由物料守恒知:5c(Cl - )=4c(HCO3 - ) 4c(CO3 2 - ) 4c(H2CO3),故②正确。
c 点滴入25mL盐酸反应后溶质为NaHCO3和NaCl,由质子守恒知: c (OH - ) c (CO3 2 - )= c (H ) c (H2CO3),③错。
d 点滴入50mL盐酸反应后溶质为NaCl和H2CO3,由电荷守恒知: c (Na ) c(H )= 2c (CO3 2 - ) c (HCO3 - ) c (OH - ) c(Cl - ) ,因 c (Na )= c (Cl - ) ,故④正确。正确答案为 D 。
三、强碱滴定弱酸曲线图的应用
例4. 常温下,用 0.1000mol·L - 1 NaOH 溶液滴定 20.00mL0.1000mol·L - 1 CH3COOH 溶液,滴定曲线如图。下列说法正确的是 ( )

A .点 ① 所示溶液中: c (CH3COO - ) c (OH - )=c(CH3COOH) c (H )
B .点 ② 所示溶液中: c (Na )=c(CH3COOH) c (CH3COO - )
C .点 ③ 所示溶液中: c (Na )>c(OH - )>c(CH3COO - )>c(H )
D .滴定过程中可能出现: c (CH3COOH)>c(CH3COO - )>c(H )>c(Na )>c(OH - )
解析: 强碱滴定弱酸的 突跃小,且恰好中和时溶液处于弱碱性 ( 生成的强碱弱酸盐水解呈碱性 ) ,若选择指示剂,只能选择碱性范围内变色的酚酞。识图: 滴定曲线中的点 ①处是 滴入 10.00 mLNaOH 溶液中和后得到等量的 CH3COOH 与 CH3COONa 的混合溶液,由电荷守恒知: c (CH3COO - ) c (OH - )=c(Na ) c (H ) , CH3COOH 的电离程度大于 CH3COONa 的水解程度, c (Na )>c(CH3COOH) , A 错;
点 ②处 是 pH = 7 的 CH3COONa 与少量 CH3COOH 的混合溶液 , c (OH - )=c(H ) ,由电荷守恒知: c (Na )=c(CH3COO - ) , B 错;
点 ③处是 CH3COONa 的 弱碱性溶液, c (CH3COO - )>c(OH - ) , C 错;点 ①之前 加入少量的 NaOH 溶液时,可以得到少量 CH3COONa 与较多量 CH3COOH 的混合溶液,离子浓度会出现:
c (CH3COOH)> c (CH3COO - )> c(H ) >c(Na )>c(OH - ) ,正确答案为 D 。
例5. ( 浙江高考 )25 ℃ 时,用浓度为 0.1000 mol·L - 1 的 NaOH 溶液分别滴定 20.00mL 浓度均为 0.1000mol·L - 1 的三种酸 HX 、 HY 、 HZ ,滴定曲线如图所示。下列说法正确的是 ( )

A .在相同温度下,同浓度的三种酸溶液的导电能力顺序: HZ
B .根据滴定曲线,可得 K a (HY)≈10 - 5
C .将上述 HX 、 HY 溶液等体积混合后,用 NaOH 溶液滴定至 HX 恰好完全反应时: c (X - )>c(Y - )>c(OH - )>c(H )
D . HY 与 HZ 混合达到平衡时 : c (H ) = [Ka(HY)·c(HY)/c(Y - )] c (Z - ) c (OH - )
解析: 识图: 滴定曲线的 突跃越大的酸,其酸性越强。在相同温度下, 同浓度的三种酸溶液的酸性: HX<</FONT>HY,故导电能力:HX<</FONT>HY,A错;
当pH=5时,10.00mL NaOH溶液滴定等浓度的HY溶液,得到等量的HY与NaY的混合溶液,由于溶液中c(H )=10-5mol·L-1,c(Y-)≈ c(HY) , K a (HY) = c (H )·c(Y - )/c(HY) ≈10 - 5 , B 正确;
当 HX 、 HY 溶液等体积混合后,用 NaOH 溶液滴定至 HX 恰好反应时,得到等量的 NaY 与 NaX ,由于 X - 水解程度大于 Y - ,故 Y - 的浓度应大于 X - , C 错;
当 HY 与 HZ 混合达平衡时,由电荷守恒知: c (H ) = c (Y - ) c (Z - ) c (OH - ) , c (Y - ) = K a (HY)·c(HY)/c(H ) , D 错。正确答案为 B 。
四、现场体验
1 . ( 山东高考 ) 室温下向 10mL0.1mol·L-1NaOH 溶液中加入 0.1mol·L-1 一元酸 HA 溶液, pH 的变化曲线如图所示。下列说法正确的 ( )
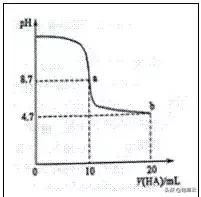
A . a 点所示溶液中 c(Na )>c(A - )>c(H )>c(HA)
B . a 、 b 两点所示溶液中水的电离程度相同
C . pH=7 时, c(Na )=c(A - ) c(HA)
D . b 点所示溶液中 c(A - )>c(HA)
2 .下列有关溶液中粒子浓度的关系式,正确的是 ( )
A . pH 相同的 ① CH3COONa 、 ② NaHCO3 、 ③ C6H5ONa 三种溶液中的 c (Na ) : ③ > ② > ①
B . 0.1mol·L - 1 某二元弱酸强碱盐 NaHA 溶液中: c (Na ) = 2c (A2 - ) c (HA - ) c (H2A)
C . 下 图中 pH = 7 时 : c (Na )>c(CH3COO - )>c(OH - ) = c (H )

D . 上 图中 a 点溶液中各离子浓度的关系是 : c (OH - ) = c (H ) c (CH3COO - ) 2c (CH3COOH)
3 . 20 ℃ 时向 20mL0.1mol·L - 1 醋酸溶液中不断滴入 0.1mol·L - 1 NaOH 溶液,溶液 pH 变化如图所示。此过程中溶液中离子浓度的关系错误的是 ( )

A . a 点: c (CH3COO - )>c(Na )>c(H )>c(OH - )
B . b 点: c (Na )=c(CH3COO - )>c(H )=c(OH - )
C . c 点: c (H )=c(CH3COOH) c(OH - )
D . d 点: c (Na )>c(CH3COO - )>c(OH - )>c(H )
4 . ( 诸城模拟 ) 现有常温下甲、乙、丙三种溶液,甲为 0.10 mol·L - 1 的 NaOH 溶液,乙为 0.10 mol·L - 1 的 HCl 溶液,丙为 0.10mol·L - 1 的 CH3COOH 溶液,试回答下列问题:
(1) 甲溶液的 pH = ________ 。
(2) 丙溶液中存在电离平衡为 _________________ ( 用电离平衡方程式表示 ) 。
(3) 甲、乙、丙三种溶液中由水电离出的 c (OH - ) 的大小关系为 ______ 。
(4) 某同学用甲溶液分别滴定 20.00mL 乙溶液和 20.00mL 丙溶液,得到如图所示两条滴定曲线,请完成有关问题:

① 甲溶液滴定丙溶液的曲线是 ______( 填 “ 图 1 ” 或 “ 图 2 ” ) ;
② a = ________mL 。
5 .现有 25 ℃ 时 0.1mol·L - 1 的氨水和 0.1mol·L - 1 的 NaOH 溶液,若向各 20mL 的氨水和 NaOH 溶液中分别滴加 0.1 mol·L - 1 的稀盐酸,滴定曲线如图所示,请回答以下问题。
(1) 为减少误差,滴定氨水时宜选用 作为指示剂。
(2) 计算 25 ℃ 时此氨水的电离度 α(NH3·H2O)= 。
(3) 分析滴定曲线,下列说法正确的是 。

A . 滴定氨水曲线中 a 点时: c (Cl - )>c(NH4 )
B . 滴定过程中的任何一点均有: c (Cl - ) c(OH - )=c(NH4 ) c(H )
C .当滴到 pH=7 时,滴定氨水消耗的 V( 盐酸 )<20 mL ,滴定 NaOH 消耗的 V( 盐酸 )=20 mL
D .当滴定氨水消耗的 V( 盐酸 )
20mL 时,一定有: c (Cl - )> c(NH4 )>c(H )>c(OH - )
(4) 当在浓度均为 0.3mol·L-1 的氯化铵和氨水的混合溶液中滴加少量稀盐酸或稀 NaOH 溶液,发现溶液的 pH 几乎不变,其原因是 。
五、参考答案:
1 . D 2 . D 3 . C
4 . (1)13 (2)CH3COOH

CH3COO - + H H2O

OH - + H
(3)丙>甲=乙 (4)①图2 ②20.00
5 . (1) 甲基橙 (2) 1% (3)BC
(4) 在氯化铵和氨水的混合溶液中存在平衡: NH4 H2O

NH3·H2O H , NH3·H2O

NH4 OH - ,当向混合液中加入少量酸溶液时,氯化铵的水解平衡向左移动,氨水的电离平衡向右移动, c (H ) 增加不大;当向溶液中加入少量碱溶液时,氯化铵的水解平衡向右移动,氨水的电离平衡向左移动, c (OH - ) 增加不大。因此,当加入少量酸或碱时溶液的 pH 几乎不变。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






