大学化学压强平衡常数(工科化学四四水溶液化学)
5.3相平衡和非水溶液的化学反应
在5.3.1中我们讲了水溶液中的气液平衡,重点讲了亨利定律,详解了拉乌尔定律和亨利定律的应用条件和应用领域。下面我们水溶液的相关性质以及之间的规律
5.3.2溶液中的气-液和液-液平衡
5.3.2.1相图
狭义:相平衡系统的组成与一些参数(如温度、压力)之间关系的直观图(图表比文字直观简洁)
广义:给定条件下,体系中各相之间建立平衡后热力学变量强度变化的轨迹的几何表达

水的三相图
大部分聚集态中,并不能适用拉乌尔定律和亨利定律来推算其液相和气相组成,必须根据实验来做出相图和推算组成
1)完全互溶的气-液平衡相图
泡点和泡点线:液体开始出现气泡的温度(下图中的粉色线)
露点和露点线:气体开始出现液滴的温度(下图中的蓝色线)
恒沸点:露点和泡点重合的温度,有特定的摩尔分数
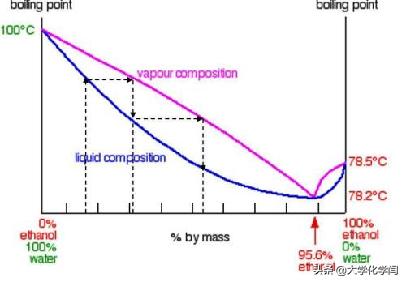
乙醇/水混合物的平衡相图
蒸馏提纯的上/下限就是恒沸点的数值。通过恒沸点的摩尔分数变化不能通过蒸馏提纯得到。
常见恒沸物:恒沸物有固定的摩尔分数和恒沸温度。
盐酸(20.24%)/水:108.5℃;
氢溴酸(47.38%)/水:126℃
硫酸(98.3%)/水:338℃
苯(91.2%)/水:69.25℃
苯(18.5%)/乙醇(74%)/水:64.9℃
2)部分互溶的液-液平衡相图
在298.15K时,水中逐渐加入异丁醇,
当异丁醇的质量分数小于8.5%时,溶液为单相(不饱和异丁醇的水溶液);
当异丁醇的质量分数大于8.5%且小于83.6%时,溶液为两相(上层为异丁醇的饱和水溶液,下层为水的异丁醇饱和溶液);
当异丁醇的质量分数大于83.6%时,溶液为单相(不饱和水的异丁醇溶液)

丁醇-水的平衡相图
部分互溶的液液二元系统,其溶解度随温度而改变,绝大多数随温度升高而溶解度变大,在温度到达一定程度后,二者可以互溶
2)临界状态和超临界状态
每种液体都存在一个特殊的温度,在该温度以上,无论加多大的压力,都不能使气体液化。我们称这个温度为液体的临界温度,用Tc表示,临界温度是使气体能够液化所允许的最高温度。
对应于临界温度下能使气体液化所需要的最低压力称为临界压力,以Pc表示。
系统处于临界温度、临界压力下的状态称为临界状态。
温度大于临界温度、压力高于临界压力的状态,称为超临界状态
超临界的典型物质:可燃冰(本节封面就是可燃冰)
超临界状态下,物质的原子结合态会发生很大变化,有部分化学家主张把超临界物质列为物质新的聚集形态,典型代表:天然气水合物(可燃冰)
分子式mCH4•nH2O(n/m=5~8),1m3的可燃冰可以释放出164m3的甲烷,白色冰状固体,遇火即燃,又叫做固体瓦斯或者汽冰(可以放在手上燃烧,热量被水带走了)。
一般在深海(2000米以上)或者冻土层中,因为形成过程需要有很大的压力(大于临界压力)
日本最早于2013年从深海开采过,仪器工作6天,后被堵塞。我国最早在2017年/2020年2月在南海开采过。总的来说,目前可燃冰开采技术并不成熟。
3)蒸馏和萃取
都是分离技术,蒸馏是气-液平衡技术,萃取是液-液平衡技术
在97.11℃时,乙醇的水溶液中,液相中乙醇的摩尔分数为0.012的时候,气相中乙醇的摩尔分数是0.100,蒸馏是根据在气液两相中物质的比例不同而进行分离的。所以蒸馏一般纯度要求不高,当制备高纯度的时候,需要进行多次蒸馏,即精馏。在石化行业的炼油厂的石油精馏,和酿酒业的原酒蒸馏,就是此原理
萃取是液液平衡的应用。根据溶质在不同溶剂中的溶解度差异,选择一种溶剂使得欲分离的组分溶于其中,其他组分不溶于或者少溶而获得分离。
有正己烷和苯的混合溶液,欲使其分离,选择一个只溶解苯或者只溶剂正己烷的溶剂(二甘醇只溶解苯,不溶解正己烷),加入二甘醇后,相城两相体系,下层是二甘醇和苯的溶液,称为萃取相,上层是正己烷,称为萃余相
在压力大约临界压力,温度低于临界温度下进行的萃取下进行的萃取过程,称为超临界萃取。常用于有机物的分离、废水处理、稀有气体的提取等。最常用的CO2的超临界萃取,食品行业常用CO2的超临界萃取来提取油料作物的油脂成分,效果良好
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






