质量守恒定律注意问题 运用质量守恒定律

“质量守恒定律”是自然科学中的重要定律之一。我们在运用中应注意以下几个问题:
1、只能是质量守恒,不是其他物理量守恒
例题:有44.8升氢气与22.4升氧气恰好完全反应,可生成水蒸汽多少升?(假若反应前后的温度和压强均不变)
错误解法:因为是适量的两种气体完全反应,所以根据质量守恒定律:44.8升 22.4升=67.2升
以上解法就错在把“质量守恒”当作“体积守恒”。
正确的解法:实验测得,相同温度,相同压强下,相同体积的气态物质里所含的分子数是相同的。那么,在相同温度,相同压强下气态物质间的分子数之比应为它们的体积之比。根据化学方程式:2H2 + O2=
点燃
2H2O(气)可知,氢气、氧气和水蒸气的分子数之比为2 :1 :2,所以44.8升氢气与22.4升氧气反应后,生成的水蒸气体积应为44.8升。
2、不要只注意“质量总和”,而忽视了“参加反应”
如河南省中考题:
某同学根据“铁生锈后质量会增加”,推测质量守恒定律也有例外,你认为该同学的推测正确吗?请加以解释。
解析:铁生锈后质量会增加,恰恰说明化学反应遵循质量守恒定律,因为铁生锈是铁和水、氧气等物质发生了化学反应,增加的质量是参加反应的水、氧气等物质的质量.
答:不正确;铁生锈是铁和水、氧气等物质发生了化学反应,增加的质量是参加反应的水、氧气等物质的质量.
再如:4克碳与8克氧气反应能生成12克二氧化碳的说法就是错误的。
根据化学方程式:C + O2 =
点燃
CO2
12 32 44
解析:由上式不难看出,12份质量的碳与32份质量的氧气反应,生成44份质量的二氧化碳。碳、氧气、二氧化碳的最简质量比只能为3:8:11,显而易见,能与8克氧气反应的碳只能是3克(剩余1克没有参加反应)。根据质量守恒定律可知:生成二氧化碳的质量应为3克 8克=11克
或设:与8克氧气完全反应的碳的质量为X。
C + O2 =
点燃
CO2
12 32
X 8克
12 :32=X :8克 解得X = 3克
生成二氧化碳的质量为:3克+8克=11克
如果题目给的数据比较复杂,不易看出哪种物质是过量的,也可根据比例关系找出过量的物质。如:
C + O2 =
点燃
CO2
12 32
4克 8克
在一个比例式中,两内项乘积等于两外项乘积。如果不相等,则说明此比例不成立。上式可看出:
32 × 4克 > 12 × 8克
也就说明C过量,本题只能按氧气的质量列比例运算。
3、不仅要注意“参加反应”,还要注意生成物的“质量总和”
如河南中考题
某同学按右图装置对质量守恒定律进行实验探究,结果观察到反应后天平不平衡,由此得出这个化学反应不遵守质量守恒定律的结论。这个结论是否正确?为什么?
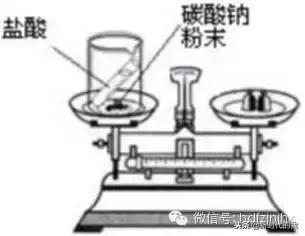
解析:质量守恒定律的探究中,物质必须是所有的反应物和所有的生成物质量才能相等。盐酸与碳酸钠反应后有二氧化碳生成,由于不是在密闭容器中进行的实验,故产生的气体逸散到空气中,使反应后太平不平衡。
答:不正确,因有反应后有气体逸出,使反应后天平不平衡。
因此,在计算生成物的质量时,不能根据题目给予的任意质量数进行简单的加和,要通过分析找出参加反应的各物质质量再进行计算。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






