吉非替尼报销情况(卡博替尼屡次突破)
(S)-苹果酸卡博替尼是新型多靶点广谱抗癌药物,可抑制多种肿瘤相关的激酶受体,2012年经美国食品药品监督管理局(FDA)批准,现用于甲状腺髓样癌、晚期肾癌和肝癌的治疗。该文综述卡博替尼的治疗效果及并对已知剂型以及新剂型、粘酸盐晶型研究展望。
药物概述
苹果酸卡博替尼(CabozantinibS-Malate)是一种喹啉类化合物,由美国Exelixis生物制药公司研发,最初于2012年在美国批准上市,用于治疗甲状腺髓样癌。卡博替尼是一种多靶点分子靶向药物,目前,已经在肾癌、甲状腺癌、肝癌、软组织肉瘤、非小细胞肺癌、前列腺癌、乳腺癌、卵巢癌、肠癌[1]等多种实体瘤中,证实了较好的治疗效果,对于骨转移的控制效果尤其突出。因其对于多种癌症的广泛有效性,卡博替尼被称为靶向药中的“万金油”,具有广谱抗癌能力。
于2014年3月21日获得欧洲药物管理局(EMA)批准上市,商品名为Cometriq®;于2016年4月25日批准为晚期肾癌患者的一线治疗药物[3],由益普生在欧洲上市销售,商品名为Cometriq®和Cabometyx®[4]。2019年1月,根据CELESTIAL三期临床试验结果,获得FDA批准用于肝细胞癌。
1. 治疗甲状腺髓样癌(medullary thyroid cancer, MTC)
卡博替尼通过多靶点发挥作用显示更好的疗效,实验表明,卡博替尼组与安慰剂组相比无进展生存期延长了75%,而用药所出现的腹泻、口腔炎、食欲不振等不良反应可通过调整用药剂量等方法控制,成为治疗MTC的明星药物。
2. 治疗晚期肾癌(renal cell carcinoma, RCC)
卡博替尼作为新型分子靶向抗癌药物在晚期肾癌患者的临床应用中获得良好的疗效:用临床常用药依维莫司为对照组,卡博替尼可使患者总生存期延长29.7%。用一线治疗药物舒尼替尼作为对照组,有效率46%VS 18%,无进展生存期8.2 VS. 5.6个月,更重要的是总生存期30.3 VS. 21.8个月。由此可见,卡博替尼对晚期肾癌患者的治疗表现出更好的临床效果。
3. 治疗肝癌(hepatocellular carcinoma, HCC)
接受卡博替尼治疗的晚期肝癌患者生存期明显延长,死亡风险下降了37%,客观有效率大约为5%。目前,卡博替尼已经和瑞戈非尼、PD-1抗体等药物一道,成为晚期肝癌治疗药物之一。接受过索拉非尼治疗的晚期HCC患者,卡博替尼组的中位生存期达到了11.3个月,而安慰剂组为7.2个月,效果明显。在2018年9月,CHMP对卡博替尼作为单药治疗提供了积极意见,该治疗用于治疗先前接受过索拉非尼治疗的成人的HCC。
海湾制药孟加拉公司在孟加拉生产的卡博替尼全球首仿药Cabozanib已上市,其在活性成分、给药途径、剂型剂量、使用条件和生物等效性上和原研药完全一致,在临床上可相互替代使用。卡博替尼原厂药价格十分昂贵,在香港地区,价钱在每个月5.5万左右,其孟加拉仿制版每盒约7500元左右,每个月大概1万左右,在价格上具有一定的优势。
目前国内有北京赛林泰医药、正大天晴、南京华威医药、江苏奥赛康药业、上海汇伦江苏药业、湃朗瑞医药科技等公司申请了卡博替尼临床试验,正大天晴已经完成了卡博替尼生物等效性实验,然而仿制优势并不明显。
卡博替尼从研发到上市共花费8年多的时间,总研发费用近20亿美元,至2017年销售收入累计约为2.5亿美元,占研发投入比重仅12.5%,与其他靶点肿瘤靶向抑制剂而言占比偏低。由于卡博替尼的明显作用机制,卡博替尼的销量增势明显,因而对其前景非常乐观。
已上市剂型及新剂型研究
1. 已上市剂型
在最初的开发实验中,卡博替尼被发现是BCS类Ⅱ化合物,具有低溶解度和高渗透性。在水中的溶解度较低,最初被认为不适合开发固体口服制剂,因此药物开发的重点是寻找具有适当吸水性、热稳定性、化学稳定性、溶酶稳定性和溶解度的盐,考虑到S-苹果酸盐卡博替尼具有开发的药物性质的优质组合,在测定纯度、湿度和溶解度方面未显示变化,其晶体和无定形形式的表现优于Cabozantinb的游离碱和其他盐的有益性质,Exelixis选择以卡博替尼的苹果酸盐形式作为开发固体制剂的活性成分。
卡博替尼固体口服制剂现有片剂和胶囊两种剂型,规格不同。可根据产生的不良反应调整用量,但禁止胶囊剂型与片剂剂型相互替代使用。治疗甲状腺癌吃卡博替尼胶囊,治疗肾细胞癌吃片剂。
卡博替尼片剂以薄膜包衣片含20mg、40mg或60mg卡博替尼供应,分别是等同于25mg、51mg或76mg的卡博替尼S-苹果酸盐,包括以下无活性成分:微晶纤维素,无水乳糖,羟丙基纤维素,羧甲基纤维素钠,胶体二氧化硅,和硬脂酸镁。膜包衣含羧丙基纤维素钠,二氧化钛,三乙酰甘油酯,和氧化铁黄。
卡博替尼胶囊规格20mg和80mg,分别含苹果酸卡博替尼20毫克和80毫克,FDA推荐的卡博替尼每日剂量为140mg(一粒80mg,三粒20mg胶囊),不与食物混用。
1.1 处方设计
选取专利CN103221035A[5]报道了一种药物组合物,其包含:30-32重量%的化合物卡博替尼(S)-苹果酸盐;50-70%的填料;2-4%的粘合剂;4-8%的崩解剂;和0.2-0.6%的助流剂和0.5-1%的润滑剂。药物组合物中,所述填料包括乳糖和微晶纤维素,粘合剂为羟丙基纤维素,崩解剂为交联羧甲基纤维素钠,助流剂为胶体二氧化硅,润滑剂为硬脂酸镁,还包含薄膜包衣欧巴代黄制成片剂。

表1. 卡博替尼片剂的一种药物组合物示例
1.2 卡博替尼片剂的生产工艺流程
将粉碎的卡博替尼(S)-苹果酸盐与微晶纤维素、无水乳糖和交联羧甲基纤维素钠预混合以形成粘合剂溶液,高剪切湿法制粒以产生湿颗粒湿法筛选经流化床干燥,研磨,再与胶体二氧化硅和交联羧甲基纤维素共混,再加入硬脂酸镁进行润滑共混,压片,薄膜包衣。
2.2 新剂型研究
随着卡博替尼已显示出广泛的临床效应,导致了针对多种肿瘤类型的新批准治疗选项,引起了人们的兴趣来评估当与检查点抑制剂联合使用时提供多靶点酪氨酸激酶抑制剂增强的药代动力学和药效动力学的新型制剂,以寻求进一步可能的协同抗癌临床效应。考虑到儿科患者和老年患者在口服固体制剂吞咽困难,更倾向于液体口服制剂易于摄取,提高用药依从性。
专利WO2018227119A[6]报道了将Cabozantinib及其在药学上可接受的盐(如,(L)-苹果酸盐,也称为(S)-苹果酸盐)与一种或多种载体掺混制备含有约85%的PEG-400(w/w)、和/或约10%的TPGS(w/w)、和/或约5%的乙醇(w/w)的口服制剂,形成溶液或悬浮液。
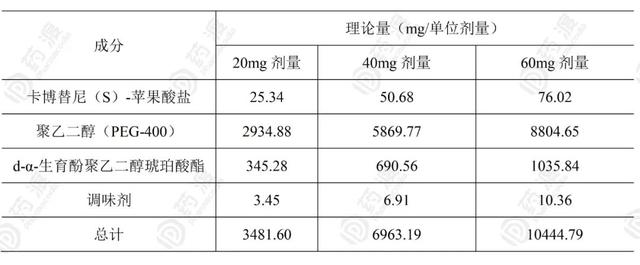
表2. 含有卡博替尼(S)-苹果酸盐的液体制剂的示例
2.3 粘酸盐及晶型
据晶云科技粘酸盐型专利CN104961681A[7]研究表明卡博替尼的粘酸盐是容易获得的,一般将卡博替尼和粘酸分别溶于溶剂(乙腈,醇类,酮类,醚类以及上述溶剂分别与水的混合溶剂体系,(10-20):1)中,使二者进行反应即得到卡博替尼的粘酸盐,无需重结晶操作,析晶即可得到稳定的盐型。所得卡博替尼的粘酸盐溶解度高,有利于提高药物的生物利用度及疗效;具有良好的稳定性,只有单一晶型,能减少多晶型药物由于转晶导致药物疗效和安全性的改变;具有较低的引湿性,制备过程中无需特殊的干燥条件,简化了药品的制备与后处理工艺,易于工业化生产。且该晶型在不同湿度条件下水分含量基本保持不变,便于药品的长期贮存,大大降低了物料储存以及质量控制成本,具有很强的经济价值。
粘酸盐晶型的X射线粉末衍射(XRPD)光谱如图1所示,该衍射图包括13.4、17.3、19.6、21.8、22.5、23.1和25.5(°2±0.2°2θ)处的峰。据TG/DTA分析中没有发现失重现象,说明是一种无水晶型。

图1. 粘酸盐晶型的X射线粉末衍射(XRPD)光谱图,来源于参考文献7
总结
目前,“万金油”卡博替尼已经在肾癌、甲状腺癌、肝癌、前列腺癌、乳腺癌等多种实体瘤中,显示了明显的治疗效果,具有广谱抗癌能力,且与特异性好的靶向药联用时具有更显著的优势。不可避免的是,卡博替尼出现副作用的情况相对较多。
Exelixis在国内申请了卡博替尼的代谢物专利、盐型专利、晶型专利、组合物专利、制剂专利、用途专利、制备方法专利。其中,盐型专利(苹果酸盐型专利)和代谢物专利限制了正大天晴等申请卡博替尼上市新药的途径。苏州晶云药物科技也拥有了卡博替尼晶型专利、粘酸盐型专利、制备方法专利、用途专利,其优势在于比正大天晴多一个盐型专利,但卡博替尼原研药代谢物在2019年已授权,卡博替尼在中国可能依旧得等到专利到期才能上市,再争取市场份额。
总的来说,考虑到卡博替尼治疗效果的巨大优势,如果国内药企能够以较低成本突破专利成功上市,将占据主要市场,后续肿瘤治疗也会持续乐观。
参考文献
[1] FDA官网. FDA grants regular approval to cabometyx for first-linetreatment of advanced renal cell carcinoma [EB/OL]. (2019-01-19)[2019-05-19]. https://www. fda.gov/drugs/ informationondrugs/ approveddrugs/ ucm589842. htm.
[2] FDA官网. NDA 203756 approval letter [EB/OL]. (2012-11-29) [2018-05-19]. https :// www. Aeeessdata. Fda. Gov/ drugsatfda_docs/ appletter/ 2012/ 203756Orig1s000ltr. pdf.
[3] FDA官网. NDA 208692 approval letter [EB/OL].(2016-04-25) [2018-05-19]. https :// www. Aeeessdata. Fda. Gov/ drugsatfda_docs/ appletter/ 2016/ 208692Orig1s000ltr. pdf.
[4] Cabometyx™ (cabozantinib) tablets. USprescribing information. Exelixis, Inc. April 2016.
[5] 埃克赛里艾克西斯公司. C-MET调节剂药物组合物 [P].中国:CN103221035A,2013-07-24.
[6] EXELIXIS INC. LIQUID DOSAGE FORMS TOTREAT CANCER[P]. US:WO2018227119A, 2018-12-13.
[7] 苏州晶云药物科技有限公司.卡博替尼的粘酸盐及其晶型[P].中国:CN104961681A,2014-11-13.
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






