高中化学易忽略的知识点(高考化学高中化学)
一、硅及其化合物:
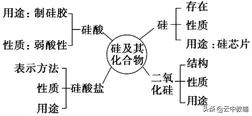

1、不要混淆二氧化硅和硅的用途:用于制作光导纤维的是SiO2,用于制作半导体材料、计算机芯片的是晶体硅。
2、水晶、石英、玛瑙的主要成分是SiO2;珍珠的主要成分是CaCO3;钻石是金刚石;宝石的主要成分是Al2O3。

1、三种“反常”
(1)还原性强弱规律反常:SiO2+2C
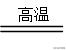
Si+2CO↑,该反应中C作还原剂,SiO2中硅原子得电子,而失电子的能力Si>C。这反常情况可从化学平衡的角度理解,由于产物CO为气体,能及时离开反应体系降低了生成物的浓度,促使反应向正反应方向进行。
(2)强酸制弱酸规律反常:
Na2CO3+SiO2

Na2SiO3+CO2↑
CaCO3+SiO2

CaSiO3+CO2↑。
一般情况下,因为碳酸的酸性比硅酸强,溶液中可发生反应Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3,即符合“较强酸制较弱酸”的复分解反应规律。而上述反应之所以能进行,是因为该反应是在高温干态条件下进行的,可从化学平衡角度理解,高温时,SiO2这种高沸点、难挥发的固体制得了低沸点、易挥发的CO2气体,因CO2生成后离开反应体系,使反应向右进行到底。
(3)氧化物的反应规律反常:一般情况,碱性氧化物+酸―→盐+水,SiO2是酸性氧化物却能与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O(SiF4不属于盐)。
2、五种溶液:通入过量CO2后溶液仍浑浊,符合条件的五种溶液是:
①Na2SiO3溶液;
②NaAlO2溶液;
③苯酚钠溶液;
④饱和的Na2CO3溶液;
⑤饱和NaCl的氨溶液(侯氏制碱原理)。
2、八个反应:常见非金属置换出非金属的反应:
2H2+SiCl4

Si+4HCl、C+H2O(g)

CO+H2、
2C+SiO2

Si+2CO↑、O2+2H2S

2S↓+2H2O
2F2+2H2O===4HF+O2、Cl2+2NaBr===2NaCl+Br2。
二、碳、硅的氧化物
1、一氧化碳:
(1)物理性质:无色气体,有毒,难溶于水。
(2)化学性质:
①燃烧:CO燃烧产生淡蓝色火焰,2CO+O2

2CO2。
②还原CuO:Cu+CO
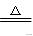
Cu+CO2(冶炼金属)。
2、二氧化硅和二氧化碳:


玻璃中含有SiO2,SiO2能够与碱液缓慢反应,带玻璃塞的玻璃试剂瓶一般都是磨砂口的,接触非常严密,接触碱液时间长了会生成具有黏合性很强的Na2SiO3水溶液,从而使瓶塞与瓶颈黏在一起,不易分开。

1、熟记可用CO2制取的弱酸:碳酸酸性比硅酸、次氯酸、偏铝酸等强,将CO2气体通入Na2SiO3、NaClO、NaAlO2盐溶液中,均能发生反应而生成相应的弱酸和碳酸(氢)盐,这是“强酸制弱酸”原理的应用。。
2、反应顺序的判断:当有多种组分与一种物质反应时,判断反应顺序的方法:先假设与其中的一种组分反应,若产物还能与另一种组分反应,则假设错误。如将CO2通入KOH、Ba(OH)2混合溶液中,假设CO2先与KOH反应,则生成的K2CO3会与Ba(OH)2继续反应生成BaCO3,故假设错误,应该是CO2先与Ba(OH)2反应。
3、CO2与碱反应产物的定量判断:以CO2与NaOH溶液反应为例:CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,当n(OH-)∶n(CO2)的值不同时产物如下:

免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






