单克隆抗体应用了哪些生物技术 基因免疫开发单克隆抗体需要注意的问题
近年来,人类在治疗埃博拉病毒感染的病人时发现,抗埃博拉病毒的单克隆抗体在治疗的过程中起着关键作用。科学家认为,快速有效地开发具有生物反应活性的单克隆抗体的技术对于治疗和控制人类面临的各类传染性疾病至关重要。
上个世纪90年代,人们就已经开始利用DNA免疫技术开发新型疫苗。DNA疫苗的基本原理:肌肉注射人工合成包含有病毒DNA的质粒载体,质粒在体内进行基因表达并合成对应的蛋白抗原,从而引起机体的免疫反应。这种疫苗最显著的特点是通过内源抗原提呈途径刺激T细胞产生免疫应答。然而,在实际应用中,基于该原理开发的DNA疫苗却遇到了问题,例如如何选择合适的免疫途径和免疫佐剂。早期临床研究数据表明,通过DNA疫苗免疫的患者血清效价较低,表明该方法没有很好的免疫效果。
近期人们对DNA疫苗的改进主要在以下2个方面:(1)采用更加高效的免疫途径—利用基因枪和电穿孔技术将DNA质粒导入到机体细胞内,免疫效果得到显著提升。(2)混合免疫冲击。首先用DNA质粒进行免疫,然后利用重组蛋白、灭活的病毒或者减毒活疫苗冲击,这种方法比常规的免疫冲击采用同种抗原的效果要好很多。总体而言,对小型动物进行基因免疫的效果要优于大型动物。这一特点也预示着可以采用此方法开发高质量的小鼠单克隆抗体。考虑到DNA免疫诱导这种应答的独特优势,早期的研究主要集中在T细胞免疫应答上。很少有人关注DNA免疫诱导B细胞免疫应答的在实际应用中的价值。事实上,诱导B细胞产生免疫应答更加适合开发高质量的功能性的单克隆抗体。
Meredith Hazen, Sunil Bhakta等用DNA免疫开发了一个抗多次跨膜蛋白(multi-drug resistant protein 4,MRP4)的单克隆抗体,MPR4是12次跨膜蛋白, 与肿瘤的多药耐药性的产生有关。肿瘤多药耐药性的产生对癌症的治疗是一个很大的挑战。以下为单克隆抗体的检测数据:

图1 anti MRP4抗体的检测结果
影响基因免疫开发单克隆抗体的因素:
01插入抗原序列的设计及优化
DNA疫苗是用哺乳动物表达载体构建的。表达载体的选择与设计的免疫原插入序列对抗体的功能有非常重要的影响。经典的抗体开发流程,往往需要表达重组蛋白。针对某些蛋白,特别是多次跨膜的GPCR蛋白和离子通道蛋白,全长表达非常困难,蛋白序列和结构的完整性对开发功能性抗体是非常关键的。无论是天然蛋白提取纯化还是重组蛋白的表达纯化,在操作处理过程中,蛋白的空间结构极有可能会发生改变。通过基因免疫产生的抗体能识别蛋白构象表位的概率要大很多。主要原因在于外源基因可以在体内直接表达合成具有天然构象的全长蛋白,从而引起对应的免疫应答。
DNA疫苗对于抗原序列的选择有独特的优势。大部分情况下,会选择表达全长蛋白序列,特别是多次跨膜蛋白,都有非常好的效果。而针对胞内表达的蛋白,设计者如果想改变蛋白表达的定位,可以人为的设计不同的信号肽,将胞内蛋白通过不同的信号肽的作用变成分泌表达蛋白,这样可以增强免疫效果。同样,对于一次跨膜蛋白,我们可以设计只针对胞外区的抗原序列,这样产生的抗体就是只识别胞外区的表位。开发针对细菌毒素的抗体,可以选择设计细菌毒素的某个片段序列,而不是全长,从而避免动物免疫过程中出现意外情况。
DNA疫苗的另外一个优势就是可以用相同的载体质粒构建过表达细胞株作为单克隆抗体的筛选材料,从而省略了蛋白表达纯化的步骤。根据不同蛋白的宿主来源,可以选择不同的筛选策略,详情见表2。基于过表达细胞株的筛选方法已经被应用于开发抗跨膜蛋白、病毒衣壳蛋白和胞内蛋白的单克隆抗体筛选中。在上述案例中,可以采用FACS,全细胞ELISA或者IHC筛选替代传统的重组蛋白间接elisa筛选。还有的研究人员采用一种新型的in-cell Western的方法筛选针对胞内表达、膜表达或者核表达的蛋白抗体。
表1:开发单克隆抗体中使用的DNA疫苗的抗原序列来源
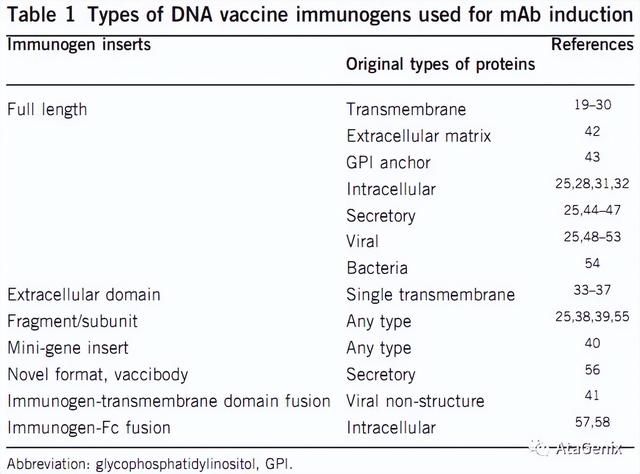
表2:单克隆抗体的筛选方法

02表达载体的选择
DNA疫苗载体的启动子序列是非常关键的调控元件。有研究通过比较CMV和human ubiquitin C promoter两种启动子对于免疫效果的影响,发现这两种启动子都能最终获得具有生物反应活性的高特异性的单克隆抗体,但是human ubiquitin C promoter这个启动子只需要一次尾静脉注射免疫就能使小鼠在七周之内维持非常高的血清效价。相对于常用的CMV启动子,还有一种高效的哺乳动物细胞表达的启动子--CAG(CMV/actin/Globin),也能显著的增强免疫效果。
03表达载体的选择
免疫方法大致分为2类:第一种方法是将人工合成DNA质粒进行注射免疫,在注射缓冲液中通过加入脂质体或者纳米粒子可以增强免疫效果。第二种方法是基于物理外力作用的基因枪技术和电穿孔技术。基因枪技术是将DNA质粒跟金纳米粒子结合在一起后,再借助高压气流将纳米粒子高速射入组织细胞内部。电穿孔技术首先是将DNA疫苗注射进入体内,然后在注射位置施加电流。总体而言,基因枪和电穿孔的免疫方法比注射免疫的方法引起动物产生免疫反应的效果要好很多,同时更加节省实验材料。另外还有尾静脉注射免疫和脾脏免疫,均能诱导动物产生对应的抗体。免疫时间间隔一般1周免疫一次,第四次免疫之后就可以检测血清免疫效果。具体免疫方法和蛋白结构分类如下表:


图2:小鼠尾静脉注射免疫操作流程
04免疫佐剂
在最开始研究人类DNA疫苗的时候,由于免疫效果较差,人们开始寻找合适的免疫佐剂以增强免疫效果。有文献报道,肠杆菌伴侣蛋白Escherichia coli chaperone protein (GroEL) 被证实可以作为一种DNA免疫的分子佐剂。在开发针对GPCR的抗体过程中可以增强免疫应答。FLT3(fetal liver tyrosine kinase 3 ligand)和GM-CSF(granulocyte-macrophage colony-stimulating factor)也可以作为一种免疫佐剂,在增强免疫效果的同时,还能诱导产生识别天然蛋白的胞外区序列的抗体。
05DNA免疫-蛋白冲击
有一种DNA免疫-蛋白冲击的混合免疫方法,可以诱导产生高效价和高亲和力抗体。这种方法前面采用常规的DNA免疫,最后一次免疫冲击采用重组蛋白,多肽或者灭活的病毒疫苗。
传统的杂交瘤细胞融合开发抗体的方法在取脾脏融合之前需要进行免疫冲击,以获得有足够多的能产生目的抗体的B细胞。基因免疫的方式也同样需要进行冲击,一般采用静脉注射或者腹腔注射的方法,在融合之前的3-5天进行。有研究表明,如果采用DNA免疫的方法在细胞融合之前没有进行冲击,总体的融合率,抗体的亲和力都会比较低,同时大部分得到的抗体都是IgM的亚型。
小结:
DNA免疫开发高质量的单克隆抗体有着以下独特的优势:
(1)可以高效地测试不同的抗原序列的免疫效果;
(2)不需要表达或者纯化抗原。特别是针对某些致病类抗原,从而避免了生物安全性的问题。
(3)针对某些突发的传染性疾病,一旦基因序列被确认,就可以快速开发对应的抗体。
(4)可以开发针对构象表位的抗体;
(5)可选择的免疫宿主广泛,包括小鼠、兔子和人。
最后打一波广告:
普健生物目前正在进行基因免疫开发单克隆抗体的测试,主要是针对PDL1,PD1以及一些膜蛋白的项目,目前已有项目正在进行亚克隆,欢迎有需要的客户咨询。
另外,应广大客户要求,本实验室提供以下单克隆抗体开发相关的关键试剂,质量有保障,欢迎大家选购:
|
特点 | |
|
单组分TMB |
不需要A/B液,反应快,5min之内出结果。 |
|
杂交瘤细胞株sp2/0 |
融合率高, 1次融合稳定在4000个融合克隆以上,最高融合克隆数可达10000以上,融合板及亚克隆7-10天即可进行ELISA筛选;融合细胞不需要饲养细胞。 |
|
羊抗鼠二抗 |
质量稳定,效价高。 |
参考文献:
1 Shuying Liu,Shixia Wang,Shan Lu et al.DNA immunization as a technology platform for monoclonal antibody induction. Emerging Microbes and Infections 2016(5), e33;
2 Meredith Hazen,Sunil Bhakta et al.An improved and robust DNA immunization method to develop antibodies against extra-cellular loops of multi-transmembrane proteins. mabs 2014;6:1, 95–107.
3 Lyon GM, Mehta AK, Varkey JB et al. Clinical care of two patients with Ebola virus disease in the United States. NEnglJMed 2014; 371:2402–2409.
4 Ulmer JB, Donnelly JJ, Parker SE et al. Heterologous protection against influenza by injection of DNA encoding a viral protein. Science 1993; 259: 1745–1749.
5 Fynan EF, Webster RG, Fuller DH et al. DNA vaccines: protective immunizations by parenteral, mucosal, and gene-gun inoculations. Proc Natl Acad Sci USA 1993; 90:11478–11482.
6 Wang B, Ugen KE, Srikantan V et al. Gene inoculation generates immune responses against human immunodeficiency virus type 1. Proc Natl Acad Sci USA 1993; 90:4156–4160.
7 Wolff JA, Malone RW, Williams P et al. Direct gene transfer into mouse muscle in vivo.Science 1990; 247:1465–1468.
8 Jones S, Evans K, McElwaine-Johnn H et al. DNA vaccination protects against an influenza challenge in a double-blind randomised placebo-controlled phase 1b clinical trial. Vaccine 2009; 27: 2506–2512.
9 Kalams SA, Parker SD, Elizaga M et al. Safety and comparative immunogenicity of an HIV-1 DNA vaccine in combination with plasmid interleukin 12 and impact of intramuscular electroporation for delivery. JInfectDis 2013; 208:818–829.
10 Lu S. Heterologous prime-boost vaccination. Curr Opin Immunol 2009; 21:346–351.
11 Wang S, Kennedy JS, West K et al. Cross-subtype antibody and cellular immune responses induced by a polyvalent DNA prime-protein boost HIV-1 vaccine in healthy human volunteers. Vaccine 2008; 26:3947–3957.
12 VaineM,WangS,LiuQ et al. Profiles of human serum antibody responses elicited by three leading HIV vaccines focusing on the induction of Env-specific antibodies.PLoS One 2010; 5:e13916.
13 Ledgerwood JE, Wei CJ, Hu Z et al. DNA priming and influenza vaccine immunogeni-city: two phase 1 open label randomised clinical trials. Lancet Infect Dis 2011; 11:916–924.
14 VaineM,WangS,HackettA et al. Antibody responses elicited through homologous or heterologous prime-boost DNA and protein vaccinations differ in functional activity and avidity. Vaccine 2010; 28:2999–3007.
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com