酸和碱什么关系(什么是酸什么是碱)
什么是酸?什么是碱?
(一)定义
在探讨人体酸碱平衡障碍的文献中,对于酸和碱有三种不同的定义。我们在书籍、杂志中,经常可以见到三种定义混用,甚至并用,容易导致混乱。三种定义如下:
1.酸是阴离子,碱是阳离子
| Na | 142 | HCO3- | 27 |
| K | 4(5) | Cl- | 101(103) |
| Ca | 5 | HPO4= | 2 |
| Mg | 2 | SO4- | 1 |
| 153(154) | RCOO- | 6(5) | |
| 蛋白- | 16 | ||
| 153(154) |
2.酸是固定阴离子,碱是固定阳离子
| 碱 | 酸 |
| Na | Cl- |
| K | HPO4= |
| Ca | SO4- |
| Mg | RCOO- |
| 蛋白- |
“固定”是与“可挥发”相对应而言的,意即不能挥发的意思。如HCO3-可以生成CO2而从呼吸排出,即为可挥发的,因而不列入酸这一项中。其实这个定义是为了纠正前一个定义中把HCO3-作为酸这一明显错误的。HCO3-在体液pH条件下系一碱性物质,它能结合H 以减少[H ]的浓度。
3.酸是H 供给者,碱是接受者或OH-供给者
上述三种定义中的第三种是合理的,它与化学上的概念一致,也真正反映体内离子的化学作用。即在体内能解离生成H 者为酸,能接受H 者为碱。体液pH值就是反映体液中H 离子浓度的。酸碱平衡障碍所研究的基本变化就是[H ]在体液中的升降。
根据第三种定义则Na 、K 、Ca 、Mg 非酸亦非碱,所有表中所列的阴离子在体内均起碱的作用。近年在酸碱平衡障碍的有关文献中已逐步使用第三种概念以代替前二种。
阴离子(除HCO3-外)增多为何酸中毒?——阴离子不是酸,但又有高血氯性酸中毒的说法(而Cl-是碱),这如何理解?这是因为除HCO3-以外的阴离子增加时,在维持离子平衡的过程中,最容易变动的HCO3-就减少(例如肾脏对它的重吸收减少,排出量就增加)。根据质量作用定律,上面的化学反应式右侧的HCO3-不断减少,反应向右进行,生成的H 就多,体液(H )升高,pH值下降而趋于酸中毒。
阴离子(除HCO3-外)减少如何碱中毒?——与上面者相反,此时最容易变动的HCO3-就增多,上面化学反应式的反应向左进行,(H )降低,pH值上升,趋于碱中毒。
阳离子增多如何碱中毒?——通常阳离子增多是伴以最易变动的HCO3-相应增多的,而HCO3-增多能使上述反应式的反应向左进行,H 被消耗而减少,pH值上升而趋于碱中毒。但有时阳离子增多并不伴有HCO3-增多,而是伴以其它阴离子如Cl-增加。此时HCO3-不增加,因而不发生碱中毒。所以说,“阳离子为碱,它的增加就会引起碱中毒”是不正确的。例如高钠血症、高钾血症并不与碱中毒等同。
阳离子减少为何酸中毒?——通常阳离子减少是伴以HCO3-相应减少的,而HCO3-减少能使反应向右进行,[H ]升高,pH降低而趋于酸中毒,但有时阳离子减少并不伴以HCO3-减少,因此阳离子减少不一定酸中毒的。同时,也可看出第三种定义比较精确,接触了问题的根本。使用第三种定义,也使酸碱中毒的概念明确。
按照第三种定义,上面所列体内阴离子均为碱,但它们的强弱不同。其强弱标准是以其接受H 的能力而定的。例如HCO3-比Cl-强的多,HCO3-是缓冲系统的重要缓冲碱,而Cl-则否。HCO3-接受H 生成H2CO3-,其在体内的解离度仅为Cl-接受H 生成的HCl的1/1500。换言之HCO3-“抓住”H 抓得更牢固,而Cl-则“抓”得很不牢,因为体内HCl几乎全部是呈解离的。
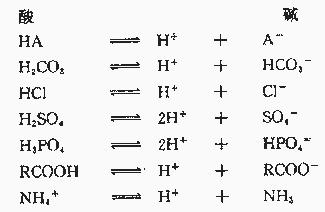
免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






