地球上有没有非碳基生命(为什么地球选择了碳基生命)
请问:地球上的碳元素多还是硅元素多呢?如果你的回答是硅元素更多,那就恭喜你答对了。实际上,地球上的硅元素可能比你想象中的还要多,根据科学家的估算,地球上碳元素的总质量大概只有硅元素的千分之一。

那么问题就来了,既然如此,为什么地球选择了碳基生命,而不是硅基生命呢?
正如我们所知,化学反应是生命的基础,因此要搞清楚这个问题,我们需要从元素的化学性质来讲起。

如上图所示,在元素周期表中,排在最右边那一列的所有元素的化学性质都非常稳定,在常温常压下,它们都是单原子气体,极难发生化学反应,因此它们就被称为惰性元素(或者惰性气体)。
从原子结构来看,这些元素除了2号元素氦(氦只有两个电子)之外,其余的6种的最外层的电子数量都是8个,例如10号元素氖(Ne)是这样的:
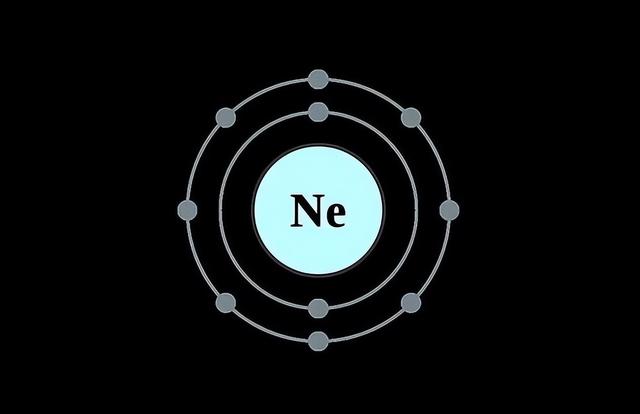
18号元素氩(Ar)是这样的:

无论对于哪一种元素来讲,它们都是“天生”就趋向于稳定,所以如果有机会的话,元素周期表中的那些非惰性元素就会趋向于让自己也形成和惰性元素一样的原子结构,假如一个原子最外层电子的数量较少,那么它就趋向于送走其最外层的电子,其失去电子的能力就比较强,比如说11号元素钠(Na)的原子结构是这样的:

可以看到,钠原子最外层只有一个电子,它只需要将这个电子送走,其第二层电子就可以变成最外层,而这一层的电子数量为8,它就达到了稳定。
反过来讲,如果一个原子最外层电子的数量较多,那么它就趋向于从外界得到一个电子,其得到电子的能力就比较强,比如说17号元素氯(Cl)的原子结构是这样的:

可以看到,氯原子最外层有7个电子,它只需要再获得一个电子,就可以达到稳定。
正因为如此,钠元素和氯元素的化学性质都非常活泼,它们中的一个天天想送走一个电子,另一个则随时都在琢磨在哪里去得到一个电子,当这俩遇到一起的时候,当然是一拍即合,一个愉快地送,一个开心地拿。

在此之后,钠原子因为失去一个电子就带上了正电,而氯原子却因为得到一个电子而带上了负电,于是它们就紧紧地结合在了一起,形成了非常稳定的氯化钠分子(NaCl,也就是食盐的主要成分)。
钠和氯的这种结合方式被称为“离子键”,除了这种“一个送、一个拿”的结合方式以外,原子之间其实还有另一种方式来达到稳定的效果,那就是与对方共享自己的电子。比如说8号元素氧(O)长这样:
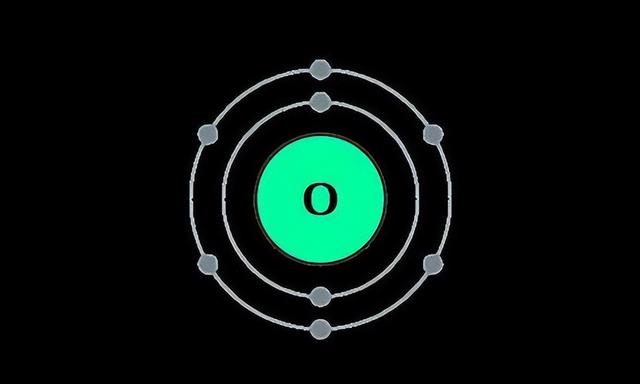
可以看到,氧原子最外层有6个电子,它还需要再获得两个电子才可以达到稳定。
为了方便描述,我们不妨用一下拟人的手法,即:对于一个氧原子来讲,假如它的周围还有一个氧原子的话,它就会与其商量:“你看,我差两个电子,你也差两个电子,不如我们各自拿出两个电子来共享,这样我们自己剩下的4个电子,再加上4个共享的电子,不就成为8个电子的稳定结构吗?”另一个氧原子想了一下,觉得确实是这么回事,于是这两个氧原子就通过共享的电子结合成了氧气分子(O2)。
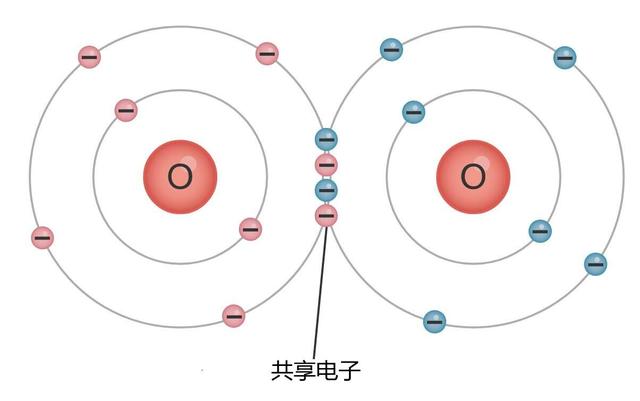
这种结合方式被称为“共价键”,其实前面提到的氯原子也可以通过这种方式与另一个氯原子一起结合成氯气,值得注意的是,不同种类的元素也可以通过“共价键”来结合,比如说一个氧原子可以通过“共价键”分别与两个氢原子共享电子,这样氧原子最外层就有了8个电子,而两个氢原子的原子结构也都变成了与氦元素一样的两个电子,这样就形成了稳定的一氧化二氢(H2O),也就是水分子。
有了以上的知识之后,我们再来看看碳元素(C)的原子结构:

碳元素是6号元素,其最外层有4个电子,这就很有意思了,因为无论是得到4个电子,还是失去4个电子,碳原子都可以达到稳定状态,其失去电子的能力和得到电子的能力都是一样的,所以除了少数的情况之外,碳原子一般都是形成“共价键”。
这无疑赋予了碳原子形成复杂化合物的能力,比如说氢原子需要共享一个电子,碳原子就给它一个,氧原子需要共享两个电子,碳原子就给它两个,而它剩下的电子还可以与其他的碳原子共享,其他碳原子又可以在与更多的原子结合的同时,再通过“共价键”连上另一个碳原子……
为了方便理解,我们不妨将碳原子最外层的电子比喻成4只“手”,大量的碳原子手拉着手,就可以形成长链、环状、网状、层状等等复杂的结构,而在这些结构中,几乎每一个碳原子都有“空闲”的手来拉着其他的元素,这样一来,就极大地提升了化合物的复杂性和多样性。

我们知道,有机化合物是构成地球上所有生命的物质基础,实际上,这些有机化合物全部都是以“手拉着手”的碳原子为“骨架”的复杂化合物,正是因为如此,我们才将地球上所有的生命(包括我们人类自己)都称为碳基生命,由此可见,所谓的碳基生命并不是指生命有机体的碳含量特别高。
好的,现在我们再来看看硅元素(Si)的原子结构:

硅元素是14号元素,在元素周期表中正好位于碳元素的下方,硅原子的最外层也有4个电子,而这也就意味着,硅原子也像碳原子一样拥有4只“手”,应该也拥有形成复杂化合物的能力。
正是因为如此,才有了硅基生命这种说法,简单来讲就是,如果构成某种生命的基础物质全部都是以“手拉着手”的硅原子为“骨架”的复杂化合物,那么这种生命就是硅基生命。
然而在地球上,硅根本就无法像碳那样形成具有高度复杂性和多样性的化合物,其根本原因就是硅原子比碳原子多了一个电子层,这就使得其对最外层的4个电子的控制力远低于碳原子,也就是说,尽管硅原子也有4只“手”,但这些“手”的力量天生就比碳原子弱。
这就导致了硅原子与绝大多数元素的结合都非常不稳定,比如说硅和氢的化合物甲硅烷(分子式为SiH4,由1个硅原子和4个氢原子组成) ,即便在常温常压下,也会在空气中直接发生自燃。
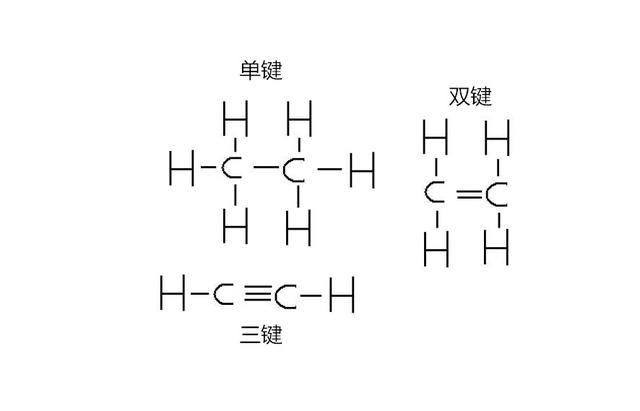
碳原子之所以能够形成长链,有一个重要的原因就是碳原子可以形成双键甚至是三键,我们可以简单地理解为,碳原子可以同时伸出两只手或者三只手去拉住对方。
而在地球上的自然环境中,硅原子却很难形成双键,因此硅原子形成的长链结构就极容易断裂,如此一来,也就无法形成以“手拉着手”的硅原子为“骨架”的复杂化合物了。
除此之外,氧和硅的结合能力又相对很强,这就导致了硅的化学反应强烈倾向于生成二氧化硅和硅酸盐,并在这些物质内部形成一种被称为“硅氧四面体”的结构(如下图所示)。
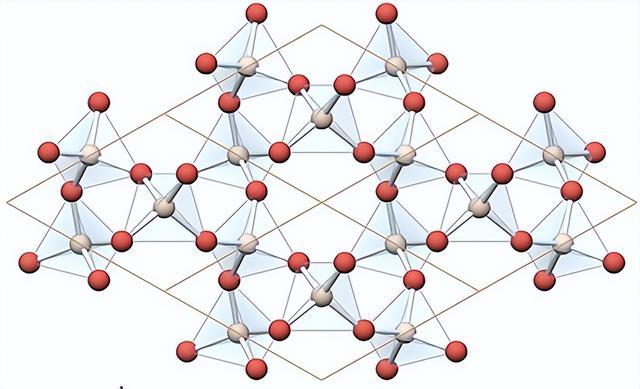
在地球上的自然环境中,二氧化硅和硅酸盐一旦生成就非常稳定,极难与其他物质发生化学反应,所以虽然地球上的硅比碳多得多,但是它们只是以无机物的形式大量存在,比如说地球上很多岩石(如花岗岩)的主要成分都是硅酸盐,而我们常见的沙子的主要成分则是二氧化硅。
正是因为上述原因,地球才选择了碳基生命,而不是硅基生命。当然了,地球上没有硅基生命并不能说明宇宙中就不可能存在硅基生命,从理论上来讲,在特定的自然环境中,硅基生命是有可能存在的。如果真是这样的话,那硅基生命长什么样呢?我们接着看。
在压强足够高的条件下,硅原子也是可以形成双键的,而在低温的环境中,硅与非氧元素形成的化合物可以保持稳定,除此之外,我们还要排除氧和硅的结合问题,因此在高压、低温并且缺氧的强还原性环境中,就可能形成以“手拉着手”的硅原子为“骨架”的复杂化合物,进而演化出生命。

这样的条件可以出现在那些低温的星球上,在低温的条件下,氢、氦、氮、甲烷等等物质都能够以液态存在,而如果这些液体足够多,就可以形成巨大的海洋,在这些海洋的底部,就形成了高压、低温并且缺氧的强还原性环境。
不过由于低温下的化学反应通常都不够活泼,不足以支持高级生命体的活动,因此就算在这种条件下存在硅基生命,它们也应该只是一些简单的硅基微生物。
另一方面来讲,由于氧和硅的结合能力很强,因此如果用氧原子来“搭桥”的话,就可以形成“Si-O-Si-O-Si……”这样的长链结构,而足够高的温度则可以让“硅氧链”避免出现上述的“硅氧四面体”结构,进而使得“硅氧链”出现这样的情况:
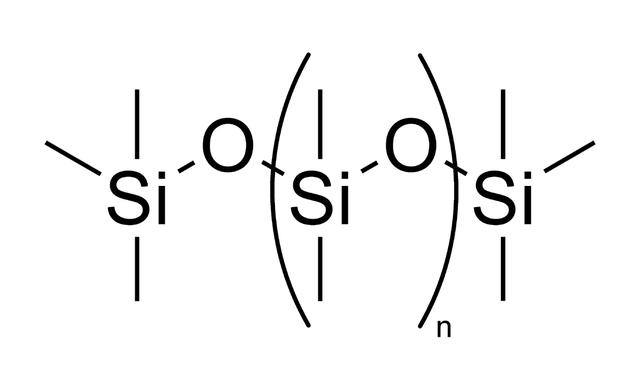
这就相当于硅原子就有了“空闲”的手来拉着其他的元素,在此基础上,如果再加上高压,就可能会形成复杂度和多样性都足够高的化合物,进而为演化出生命提供了物质基础。
在宇宙中,如果一颗拥有岩石表面的行星的质量足够大、大气层足够厚、距离其主恒星足够近,其星球表面就可以存在高温高压的环境,也就是说,在这样的星球上就有可能存在复杂的硅基生命。

实际上,早在19世纪末,就有科学家提出高温环境中可能会存在硅基生命,在随后的日子里,这种猜测得到了一定程度的认同,根据人们的设想,这样的硅基生命看上去就像是某种晶体,拥有透明或半透明的外观。

(↑科幻作品中的硅基生命)
当然了,以上所述的硅基生命都只是理论上的推测而已,实际上,除了地球上的碳基生命以外,我们从未在宇宙中发现过任何形式的生命,总而言之,宇宙中还有太多的奥秘等待着我们去探索。
好了,今天我们就先讲到这里,欢迎大家关注我们,我们下次再见。
(本文部分图片来自网络,如有侵权请与作者联系删除)
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






