m3白血病的三个阶段(三例细胞形态迥异的M3型白血病现形记)

前 言
M3型白血病(急性早幼粒细胞白血病,APL)是以异常早幼粒细胞增生为主的急性白血病,是目前医学上认为治疗效果最好的白血病类型,治愈率常常高达90%。但是该病进展迅速,出血倾向明显,如不及时诊断和治疗,死亡率极高。
现报道3例异常早幼粒细胞形态迥异的M3型白血病,总结M3各亚型的血液指标变化、细胞形态及融合基因特点,为减少漏诊以及快速诊断提供经验分享。
病例一案例经过
诊疗过程

检验结果

图1 凝血功能:PT延长、FIB降低

图2 血常规
WBC:10.19×109/L,血小板:3×109/L、未成熟细胞占65.5%。

图3 外周血异常早幼粒(瑞氏染色,100×)
镜下多以结构不清、布满颗粒的早幼粒为主(图3-a),部分可见内外浆(图3-b)
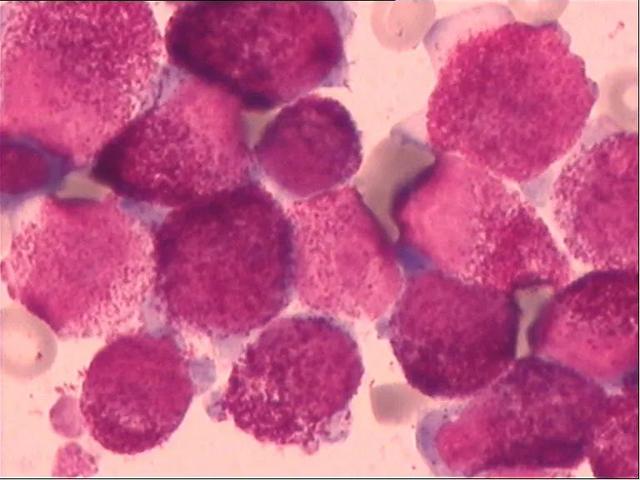
图4 骨髓象(瑞氏染色,100×)
与外周血比较,骨髓中异常早幼粒颗粒更为丰富和粗大,内外浆更明显。
综合该患者临床体征、血常规及凝血检查、外周血及骨髓细胞形态、POX染色阳性(该结果为补充说明,未展示),初步提示为M3a。迅速给予全反式维甲酸及黄黛片治疗,同时进行流式及PML-RARɑ融合基因检测以确诊,但由于患者死亡,后续检查放弃。
病例二案例经过
诊疗过程
女,51岁,因牙龈出血、血小板减少从基层医院转诊我院血液科。
检查结果

图5 凝血功能:PT延长、FIB降低、D二聚体升高

图6 血常规
WBC:4.84×109/L,PLT:4×109/L,疑似单核比例偏高占43.6%。

图7 外周血涂片(瑞氏染色,100×)
该类细胞胞浆偏蓝、核型不规则、核仁1-3个,可见细小颗粒,怀疑“原始幼稚单核细胞”,比例为70%。

图8 骨髓涂片(瑞氏染色,100×)
骨髓中出现两类细胞,一类细胞颗粒细小、形态特征偏向原始幼稚单核(a);另一类细胞颗粒明显,形态特征偏异常早幼粒(b)。

图9 骨髓涂片(瑞氏染色,100×)
骨髓中还可见奥氏小体(单根)、蝴蝶核(a)等典型异常早幼粒;上述两类细胞POX染色均呈强阳性(b)。

图10 流式细胞检测
异常细胞占83.3%、符合APL表型

图11 Fish检查:RARa基因重排阳性

图12 融合基因分型:PML/RARa-L型
综合该患者临床体征、细胞形态特点以及流式、PML-RARɑ融合基因检测,确诊为PML/RARa-L型(形态分型为M3b),给予全反式维甲酸及黄黛片治疗,目前患者病情稳定。
病例三案例经过
诊疗过程
男,43岁,因“头痛、全血细胞减少”从基层医院转诊我院血液科。
检查结果

图13 凝血功能:TT降低、D二聚体升高
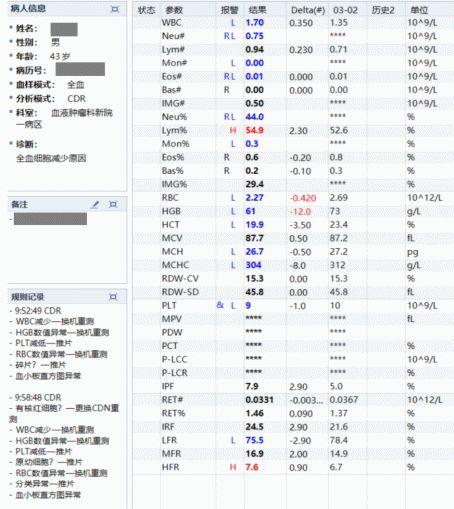
图14 血常规
WBC:1.70×109/L,PLT:9×109/L,幼稚细胞占29.4%。

图15 外周血涂片(瑞氏染色,100×)
异常早幼粒易见柴捆样奥氏小体

图16 骨髓涂片(瑞氏染色,100×)
与外周类似,易见柴捆样奥氏小体

图17 流式细胞检测
异常细胞占90.4%、符合APL表型。

图18 Fish检查:RARa基因重排阳性
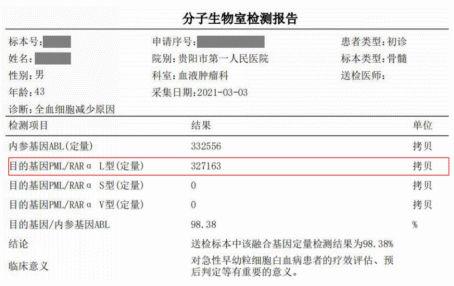
图19 融合基因分型:PML/RARa-L型
综合该患者细胞形态特点以及流式、PML-RARɑ融合基因检测,确诊为PML/RARa-L型(形态分型为M3a)。
案例分析
病例一异常早幼粒细胞布满粗颗粒,细胞结构不清晰、偶有内外浆、奥氏小体少见,形态分型为高危型M3a,死亡风险很高。
病例二异常早幼粒细胞形核型扭曲、核仁易见、颗粒少、可见单根奥氏小体,容易误导为原始幼稚单核细胞,此时POX染色是鉴别的有力手段。经过流式及融合基因检测,确诊为PML/RARa-L型。该类型异常早幼粒颗粒较少,其死亡风险相对减少。
病例三异常早幼粒细胞易见柴捆样奥氏小体,形态分型应为M3a,经流式及融合基因检测,其基因分型为PML/RARa-L型。虽然病例二、三基因分型均为PML/RARa-L型,但是在形态上完全不同。目前形态分型与基因分型的关联、以及异常早幼粒细胞中影响凝血功能障碍的颗粒成分尚不十分清楚。
上述3个病例都是近期从基层医院转诊的患者,可能是由于形态意识薄弱,基层医院虽然都进行了血常规检测,但均未在形态上进行提示。
本文总结了这3例患者的血常规散点图,发现异常早幼粒经常处在正常单核细胞分布区域,如果颗粒增多,会平行右移(图20)。

图20 血常规散点图,图中黄色虚线标识的为异常早幼粒。
总 结
由于M3的治疗方式不同于其他髓系白血病,常规化疗破坏异常早幼粒细胞导致颗粒逸出会引起凝血功能障碍,增加出血及死亡风险。
早期发现、准确分型对于临床救治意义重大。为了提高对M3型白血病的识别与重视,现将其诊治特点总结如下。
一个最明显的临床表现:出血。
M3除了常见的白血病表现如:反复发热、贫血、淋巴肿大、骨痛外,出血是该病最明显的特点和最大风险。
一般患者发病两周内会出现全身出血,有10%~20%的患者死于早期严重出血,而一旦拖到出现DIC、严重出血的症状,成功救治的几率极低,这也是本例患者死亡的主要原因。
对于普通人群而言,一旦出现皮肤瘀斑、牙龈出血、消化道出血、非妇科疾病的阴道流血等现象,一定要及时到医院就诊,排除恶性病变。
01
两种有效的治疗药物:全反式维A酸、砷剂。
如能早期发现、及时治疗,M3的缓解率在90%以上。绝大多数M3患者具有特异性染色体易位t(15;17)(q22;q12),形成PML-RARɑ融合基因,其蛋白产物导致细胞分化阻滞和凋亡不足,是M3发生的主要分子机制。
该融合基因和维甲酸X受体一起形成异源二聚体抑制促分化基因的表达,导致粒细胞分化阻滞于早幼阶段。
全反式维甲酸(ATRA)是RARɑ的配体,ARTA干扰异源二聚体的形成,把本来抑制分化的基因作用扭转为激活作用,从而促进了分化。
ARTA能从根本上抑制异常早幼粒的产生,但是对于已经生成的异常早幼粒没有杀伤功能,而砷剂能直接结合到PML-RARɑ蛋白,诱导异常早幼粒发生凋亡。
相较于化疗药,砷剂诱导的细胞凋亡相对温和,不会使血液中出现大量的早幼粒细胞所含颗粒,避免全身出血风险。全反式维A酸与砷剂联合使用,两者标本兼治,对于绝大部分M3治疗有效。
02
三种常见类型:M3a、M3b、M3c。
FBA根据异常早幼粒细胞所含颗粒将M3在形态上进行分类:如胞浆颗粒粗大、密集或融合,称粗颗粒型(M3a),该类型是最常见也最凶险;颗粒细小而密集,称细颗粒型(M3b);如外周血早幼粒细胞颗粒甚少或缺如,而骨髓中仍为典型的异常早幼粒细胞,称微颗粒型(M3c)或变异型(M3v)。
值得注意的是,PML-RARɑ融合基因与形态不一定同步。虽然普遍认为异常早幼粒中增多的颗粒是引起凝血功能障碍的主要原因,但是颗粒的真实类型和产生机制尚不明确。
目前中国急性早幼粒细胞白血病诊疗指南(2018年版)中根据WBC升高和血小板降低程度进行预后分层,进一步以异常早幼粒为靶标进行统计分析将有助于预后分层判断。
03
四个细胞特点:颗粒、蝶形核、奥氏小体、POX强阳性。
准确识别异常早幼粒细胞是诊断M3的基础,上述四个特点(也有将内外浆列为特点之一)都有可能单独或全部出现在M3的骨髓及外周血中(POX的主要作用为了区分M3与M5)。
虽然形态学存在似是而非、主观性强等弊端,但对于恶化极为迅猛的M3,血常规阅片仍是最为高效的筛查手段。
04
综上所述:M3型白血病发病隐匿,如果患者有出血表现、凝血功能异常、血小板重度减少、外周出现结构不清/颗粒较多的粒细胞,应高度怀疑M3。
对于疑似病例,检验人员准确、迅速发具检验报告能为患者争取宝贵的抢救时间,同时还能避免不必要的医疗纠纷。进一步总结不同类型异常早幼粒细胞散点图特点、提高异常早幼粒的识别能力,对于减少漏检具有积极意义。
【参考文献】
[1]马军.中国急性早幼粒细胞白血病诊疗指南(2018年版)[J].中华血液学杂志,2018,39(03):179-183.
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






