阿司匹林对小鼠痛阈的影响(艾司西酞普兰对抑郁模型大鼠脑内抑制性氨基酸变化的作用)

引用本文: 丁楷模, 李冰玥, 张咪咪, 等. 艾司西酞普兰对抑郁模型大鼠脑内抑制性氨基酸变化的作用 [J] . 中国全科医学, 2021, 24(20) : 2547-2554. DOI: 10.12114/j.issn.1007-9572.2021.00.469.
抑郁症是最普遍的精神疾病之一,据世界卫生组织(WHO)统计,全球超过3.4亿人受其影响,是全球首要致残原因之一,当病情严重时可能导致患者自杀,每年有近80万人死于自杀,其中1/3~1/2的自杀者为抑郁症患者,成为15~29岁年龄组人群的第二大死亡原因,给全球带来巨大的社会、经济负担和不良后果[1,2]。尽管近数十年来大量的科学研究对抑郁症的发病机制进行了研究,提出了各种假说。然而,目前为止抑郁症的发病机制仍不清楚。
研究表明前额叶皮质和海马与情感、认知及学习、记忆相关。慢性应激可导致内侧前额叶皮质和海马内锥体神经元减少、突触功能缺陷,体积缩小等[3,4],且功能影像学、深部脑刺激等研究也证明了抑郁症与前额叶皮质和海马的结构及功能改变有关[5,6]。临床研究发现抑郁症患者脑脊液中γ-氨基丁酸(GABA)水平降低[7],经颅磁刺激研究报道抑郁症患者GABA功能下降[8],脑磁共振波谱(MRS)研究结果显示,抑郁症患者大脑皮质区域GABA水平降低,且缓解期间GABA水平恢复正常[9],这些研究结果均表明GABA功能异常与抑郁发生有关。然而,GABA功能异常是否可被抗抑郁剂艾司西酞普兰扭转,尚未见报道。假设慢性应激可导致抑制性氨基酸(如GABA)水平发生变化,而给予艾司西酞普兰抗抑郁治疗可以逆转上述变化。本研究将构建慢性不可预见性应激(CUS)模型,该模型是研究抑郁症发病机制的重要工具,其模拟了现实生活中人遭遇低水平、纷繁复杂的慢性应激过程,可导致模型大鼠出现快感缺失样行为及懒言少动的迟滞样行为[10],是公认可靠的抑郁症模型之一。然后针对构建的CUS模型大鼠给予艾司西酞普兰治疗其抑郁、焦虑样行为,通过体质量增加量、蔗糖偏好测试(SPT)、旷场测试(OFT)、高架十字迷宫测试(EPM)、黑白盒测试(BWT)评估大鼠抑郁、焦虑样行为变化,并采用液相色谱-质谱联用(LC-MS)技术研究艾司西酞普兰对氨基酸代谢的影响。

1 材料和方法
1.1 研究时间
2016年6月—2017年3月。
1.2 实验动物
Sprague-Dawly(SD)成年大鼠,雄性,购自北京大学医学部动物部,大鼠体质量为220~240 g。动物房恒温、恒湿〔温度(22±2)℃,湿度(50±10)%〕,采用12 h/12 h昼夜节律控制(暗周期8:00~20:00)。实验开始前,动物在动物房适应性饲养7 d,自由饮水进食。
1.3 实验方法
1.3.1 分组及干预措施
实验开始时38只SD大鼠体质量为250~270 g,其中18只给予28 d CUS处理为CUS组,20只正常饲养不予CUS处理为对照组,根据干预方法不同将CUS组和对照组各分出两亚组,CUS 艾司西酞普兰组和对照 艾司西酞普兰组于第15天开始腹腔注射艾司西酞普兰(四川科伦药业股份有限公司),10 mg/kg,1次/d,连续14 d,CUS 溶媒组和对照 溶媒组于第15天开始腹腔注射0.9%氯化钠溶液,1 ml/kg,1次/d,连续14 d,具体实验流程见图1,行为学测试均在动物的暗周期进行。本研究获得北京大学医学部动物伦理委员会批准(LA2016168),实验程序均符合美国国立卫生研究院动物研究指南[11]。
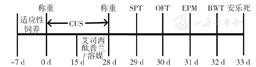
图1 实验流程图
Figure 1 Experiment flow chart
1.3.2 CUS建模流程
本实验慢性应激遵循随机、不可预见性原则,每天在不固定的时间点给予2种不同的应激[12],28 d应激方案见表1。

表1 28 d应激方案
Table 1 A 28-day stress procedure for establishing a rat model of depression
1.3.3 体质量增加量
各组大鼠在实验开始时测体质量,在慢性应激第28天再次测体质量,体质量增加量=第28天体质量-实验开始时体质量。体质量增加量用来评估大鼠抑郁样行为,体质量增加量越少,说明大鼠抑郁程度越重。
1.3.4 SPT
大鼠经过28 d CUS后分笼,单笼饲养,然后进行SPT。SPT分为蔗糖适应和偏好测试两个阶段;第一阶段蔗糖适应48 h,单笼饲养的大鼠分别给予1瓶纯水和1瓶1%蔗糖水,在第24 h时交换蔗糖水瓶与纯水瓶位置;48 h结束后进行第二阶段偏好测试,对大鼠禁食、禁水4 h后开始测试,大鼠自由饮水1 h,第30分钟时交换蔗糖水瓶与纯水瓶位置,测试前、后分别对1%蔗糖水量和纯水量进行称重。评价指标包括蔗糖偏好值和总摄入量。蔗糖偏好值=1%蔗糖水摄入量/(1%蔗糖水摄入量 纯水摄入量)×100%[12];总摄入量=1%蔗糖水摄入量 纯水摄入量。蔗糖偏好值下降可反映大鼠出现类似现实中抑郁症患者的核心症状之一:快感缺失。
1.3.5 OFT
OFT评价大鼠的空间探索能力及焦虑样行为,实验开始前大鼠适应实验室环境30 min。实验装置为长×宽×高=100 cm×100 cm×45 cm的旷场,底部划分为25个面积相等的方格。记录大鼠在旷场内5 min的自发活动,其中水平运动距离(爬格数)反映大鼠的情绪状态,如果水平运动距离降低则反映大鼠出现现实中抑郁症患者懒言少动症状;大鼠在中央区域停留时间(s)是利用大鼠在空旷环境下即好奇又担心的矛盾冲突心理,如果在中央格停留时间减少则反映大鼠出现现实生活中抑郁症患者伴发的焦虑状态[12]。每只大鼠实验结束后,清理排泄物,使用75%乙醇喷洒消除气味。
1.3.6 EPM
EPM是利用大鼠对新异环境的探究特性和对高悬敞开臂的恐惧矛盾冲突心理评价大鼠的焦虑状态,实验开始前大鼠适应实验室环境30 min。实验装置由距离地面50 cm高的一对开臂(长×宽=50 cm×10 cm)和一对闭臂(长×宽×高=50 cm×10 cm×30 cm)组成。开臂和闭臂交叉处有一个10 cm×10 cm的平台,将大鼠置于迷宫的平台上,头朝开臂,观察者距离迷宫中心至少1 m。记录5 min内大鼠进入开臂和闭臂的次数及在两臂停留时间(以四肢全部入臂或两只前爪出臂为进、出标准)。其中大鼠进入开臂停留时间,作为评价焦虑样行为的指标[13],在开臂停留时间缩短提示大鼠出现焦虑样行为。每只大鼠实验结束后,清理大鼠排泄物,使用75%乙醇喷洒消除气味。
1.3.7 BWT
BWT评价大鼠焦虑样行为,实验开始前大鼠适应实验室环境30 min。实验装置由一个长×宽×高=50 cm×30 cm×50 cm的黑盒和一个长×宽×高=50 cm×50 cm×50 cm的白盒组成,两盒之间有一孔径(10 cm×12 cm)相通,其中黑盒上顶封闭,白盒上顶开放,大鼠可在黑白盒之间自由穿梭,两盒均装有摄像头,记录大鼠开始放在白盒中间到离开白盒及在黑盒内的活动轨迹,观察时长为15 min。计算大鼠潜伏期(s)、在白盒停留时间(s)及在黑盒停留时间(s),作为评价焦虑样行为的指标[14]。大鼠在白盒停留时间越短,说明大鼠越焦虑。每只大鼠实验结束后,清理大鼠排泄物,使用75%乙醇喷洒消除气味。
1.3.8 组织样本衍生化准备
大鼠行为学测试结束后,麻醉后断头取脑,分离出额叶皮质和海马进行衍生化处理。脑组织超声匀浆后,取10 μl匀浆上清液置于试管内,加入100 μl工作液,涡旋混匀,高速离心(转速:13 200 r/min,时间:10 min,温度:4 ℃);将上清液转入另一试管,氮吹;加入60 μl衍生工作液,涡旋混匀,旋转离心(转速:13 200 r/min,时间:10 min,温度:4 ℃);65 ℃温育15 min,然后离心氮吹。加入100 μl乙腈水混合液复溶,涡旋混匀,旋转离心(转速:13 200 r/min,时间:10 min,温度:4 ℃)。使用LC-MS质谱仪检测样本。
1.3.9 LC-MS分析
在组织样本衍生化处理后,进行LC-MS分析,10 μl衍生化样本加入HPLC Ultimate 3000仪器中,液相-质谱条件:注温50 ℃,上样量10 μl,流动相A:水和0.1%甲酸,流动相B:乙腈和0.1%甲酸,CUR:20.00,CAD:Medium,CXP:5.00,IS:5500.00,DP:35.0,GS1:55.00,TEM:580.00,EP:10.0,GS2:60.00。按照表2显示梯度进行质谱检测。

表2 质谱检测梯度表
Table 2 Mass spectrometry detection gradient
1.4 观察指标
(1)比较CUS组与对照组经艾司西酞普兰和溶媒处理后的行为学变化,通过测量体质量增加量、SPT中蔗糖偏好值、OFT中水平运动距离来评估大鼠抑郁样行为变化,如体质量增加量减少、蔗糖偏好值下降、OFT中水平运动距离减少提示大鼠存在抑郁样行为变化,通过OFT中中央区停留时间、EPM中开臂停留时间、BWT中白盒停留时间来评估大鼠焦虑样行为变化,如在中央区停留时间减少、开臂停留时间减少、白盒停留时间减少均提示大鼠存在焦虑样行为。(2)比较CUS组与对照组经艾司西酞普兰和溶媒处理后大鼠前额叶皮质和海马中30种氨基酸浓度的变化。
1.5 统计学方法
采用Prism 8统计学软件对实验数据进行处理分析。计量资料以(

±s)表示,行为学数据和氨基酸数据采用双因素两水平方差分析(two-way ANOVA),post hoc分析均采用Tukey's检验。以P<0.05为差异有统计学意义。
2 结果
2.1 CUS处理和艾司西酞普兰处理对大鼠行为学的影响
CUS与艾司西酞普兰对体质量增加量无交互作用(P>0.05),CUS对体质量增加量主效应显著(P<0.05),艾司西酞普兰对体质量增加量主效应不显著(P>0.05)。在SPT中,CUS与艾司西酞普兰对蔗糖偏好值均无交互作用(P>0.05),而CUS和艾司西酞普兰对蔗糖偏好值主效应均显著(P<0.05)。在OFT中,CUS与艾司西酞普兰对水平运动距离无交互作用(P>0.05),而CUS和艾司西酞普兰对水平运动距离主效应均显著(P<0.05);CUS与艾司西酞普兰对中央区停留时间无交互作用(P>0.05),CUS和艾司西酞普兰对中央区停留时间主效应均不显著(P>0.05)。在EPM中,CUS与艾司西酞普兰对开臂停留时间存在交互作用(P<0.05),但CUS和艾司西酞普兰对开臂停留时间主效应均不显著(P>0.05);进一步分析发现,同样给予溶媒处理,CUS组大鼠的开臂停留时间较对照组大鼠缩短,差异有统计学意义(P<0.05);而给予艾司西酞普兰处理可以逆转CUS引起开臂停留时间缩短,差异有统计学意义(P<0.05)。在BWT中,CUS与艾司西酞普兰对白盒停留时间存在交互作用(P<0.05),CUS和艾司西酞普兰对白盒停留时间主效应均显著(P<0.05);进一步分析发现,同样给予溶媒处理,CUS组大鼠白盒停留时间较对照组大鼠缩短,差异有统计学意义(P<0.05);而给予艾司西酞普兰处理可以逆转CUS引起在白盒停留时间缩短,差异有统计学意义(P<0.05,见表3)。

表3 CUS组和对照组经艾司西酞普兰处理后大鼠行为学观察指标比较(
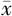
±s)
Table 3 Comparison of behavioral changes of rats in CUS group and control group treated with escitalopram or vehicle
2.2 LC-MS分析结果
在前额叶皮质中,CUS与艾司西酞普兰对总氨基酸、Glu浓度均无交互作用(P>0.05),CUS和艾司西酞普兰对总氨基酸、Glu浓度主效应均不显著(P>0.05)。CUS与艾司西酞普兰对GABA浓度存在交互作用(P<0.05),CUS对GABA浓度主效应不显著(P>0.05),艾司西酞普兰对GABA浓度主效应显著(P<0.05);进一步分析显示,同样经过溶媒处理,CUS组前额叶皮质中GABA浓度较对照组下降,差异有统计学意义(P<0.05);而给予艾司西酞普兰处理后可以逆转GABA浓度的下降(P<0.05)。CUS与艾司西酞普兰对Glu/GABA存在交互作用(P<0.05),CUS对Glu/GABA主效应不显著(P>0.05),艾司西酞普兰对Glu/GABA主效应显著(P<0.05);进一步分析显示,同样经过溶媒处理,CUS组前额叶皮质中Glu/GABA升高,差异有统计学意义(P<0.05);而给予艾司西酞普兰处理可以逆转Glu/GABA升高,差异有统计学意义(P<0.05,见表4)。而在海马中,CUS与艾司西酞普兰对总氨基酸、Glu、GABA浓度及Glu/GABA均无交互作用(P>0.05),CUS和艾司西酞普兰对总氨基酸、Glu、GABA浓度及Glu/GABA主效应均不显著(P>0.05,见表5)。
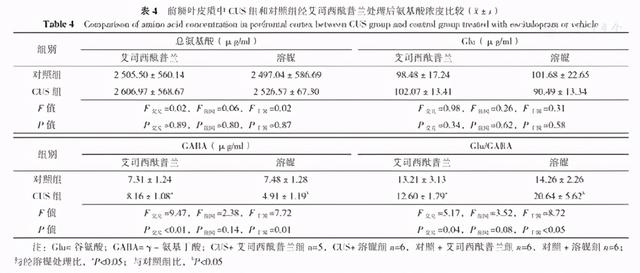
表4 前额叶皮质中CUS组和对照组经艾司西酞普兰处理后氨基酸浓度比较(
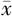
±s)
Table 4 Comparison of amino acid concentration in prefrontal cortex between CUS group and control group treated with escitalopram or vehicle

表5 海马中CUS组和对照组经艾司西酞普兰处理后氨基酸浓度比较(
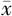
±s)
Table 5 Comparison of amino acid concentration in hippocampus between CUS group and control group treated with escitalopram or vehicle
3 讨论
本研究结果发现,慢性应激可以引起大鼠出现体质量增加量下降、SPT中蔗糖偏好值下降、OFT中水平运动距离缩短(模拟抑郁症中精神运动性阻滞)、EPM中在开臂停留时间缩短、BWT中在白盒停留时间减少等抑郁样及焦虑样行为,说明抑郁模型构建成功。而给予艾司西酞普兰可显著逆转抑郁模型大鼠出现的抑郁及焦虑样行为,但对健康大鼠均无明显影响。另外慢性应激可引起大鼠前额叶皮质中GABA浓度降低及Glu/GABA增加,给予艾司西酞普兰可显著增加GABA浓度,并恢复Glu/GABA,但在海马中无类似发现。本研究结果与既往临床研究结果[15]一致,说明前额叶皮质中GABA参与应激诱导的抑郁样行为发生,且与艾司西酞普兰发挥抗抑郁作用相关。
近年来,有研究发现慢性应激可以引起前额叶皮质中其他氨基酸,如异亮氨酸减少,天冬氨酸及丙氨酸增加的现象[16];慢性束缚应激模型中天冬氨酸、丙氨酸、Glu、谷氨酰胺等氨基酸浓度变化与抑郁样行为发生相关[15];习得性无助模型中半胱氨酸、乙酰水杨酸、甘氨酰脯氨酸等氨基酸的变化与抑郁样行为发生相关[17]等。以上研究结果存在差异,可能与选用的抑郁模型不同及选用的检测方法灵敏度不同等有关。本研究发现慢性应激导致大鼠前额叶皮质中GABA浓度下降,与GABBAY等[18]团队发现在青年抑郁症患者前扣带回皮质中存在GABA缺乏,以及胡子成[19]团队发现首发抑郁症患者血浆中GABA等氨基酸浓度下降相一致,说明无论临床研究还是动物模型研究,均证明GABA在抑郁症的发病机制中起着重要作用。
在抑郁模型大鼠前额叶皮质中发现GABA浓度下降,给予艾司西酞普兰抗抑郁治疗,GABA浓度恢复,那么GABA浓度下降是抑郁发生的因还是果?近年来,有研究利用突变小鼠模型及光化学遗传的方法来观察GABA在脑内改变情况,结果表明GABAA受体突变的小鼠[20]或者海马和皮质GABA组织减少50%的突变小鼠[21]在应激模型中可以观察到与抑郁相关的行为学表型,比如快感缺失和新奇恐惧样行为等。同样也有研究报道,选择性抑制GABA能小清蛋白(PV)神经元[22]或者生长抑素(SST)神经元[23],均可出现抑郁或焦虑样行为学表型。然而,应激时间的长短对GABA能神经元的作用不同,比如经过16 d的CUS处理,可导致前额叶皮质和海马中GABA能神经元中SST中间神经元减少而不影响PV神经元[24];经过9周的CUS处理,可以降低易感大鼠PV神经元而不影响SST神经元[25]。这些结果可能提示前额叶皮质中GABA能系统直接参与了抑郁症的发病过程,是抑郁发生的原因之一。
抑郁模型大鼠前额叶皮质中Glu/GABA显著增加,而给予抗抑郁药物治疗后可逆转Glu/GABA增加。由于前额叶皮质中Glu水平未发现显著变化,故Glu/GABA增加考虑可能为Glu向GABA转化减少,Glu转化为GABA是在谷氨酸脱羧酶(GAD)催化下,Glu转化为GABA。而GAD主要存在抑制性GABA能神经元,有研究表明GABA能神经元功能不足在抑郁症的病理生理机制中起重要作用[26],推测GABA能神经元功能异常可能导致GAD异常而影响Glu向GABA转化。
目前临床上所用的抗抑郁药物大多是通过抑制单胺能神经递质的再摄取,如5-羟色胺(5-HT)、去甲肾上腺素、多巴胺等,从而达到增加单胺能神经递质,以起到抗抑郁作用。既往研究证明,艾司西酞普兰也是通过与神经突触前膜上5-HT转运体蛋白结合,抑制5-HT的再摄取,导致突触间隙5-HT浓度升高,从而发挥抗抑郁作用[27],而本研究结果,发现艾司西酞普兰能恢复抑郁模型大鼠前额叶皮质中GABA浓度,发挥抗抑郁作用。近年来,也有类似研究报道5-HT再摄取抑制剂类药物如氟西汀,能够激活GABAA受体提高GABA能神经元兴奋性[28];新型抗抑郁药物氯胺酮也可以增强GABA能神经元[29];以上研究结果均表明GABA能神经元在抗抑郁作用中扮演着重要角色。因此,GABA能系统可能参与抑郁症的发生机制和抗抑郁治疗的机制。目前,已有以GABA能系统为靶点的抗抑郁药物进入临床研究,如GABAA受体复合物的正变构调节剂:Brexanolone[30]和SAGE-217[31]等。总之,GABA能系统在抑郁发生机制和抗抑郁机制中起着重要作用,本研究结果为之提供了新的证据。
本研究尚存在一定的缺陷。首先,用于LC-MS分析的样本量较少,未来需要增加样本量进一步验证该结果。其次,用于LC-MS分析的样本在造模后经历了行为学测试,是否对实验结果造成影响尚不能明确。以往类似研究是在做完各种行为学测试后再进行各种生化指标的检测[16]。未来需要分别用不同的大鼠进行行为学测试和生化指标检测,以排除造模后行为学测试对脑内生化指标检测的影响。最后本研究只是初步发现慢性应激可能导致大鼠前额叶皮质GABA能系统异常,而给予抗抑郁治疗后能逆转上述异常,但GABA能系统在抑郁症发病机制中的具体作用还需要进一步研究,比如可以从GABA能PV神经元、SST神经元及催化Glu转化为GABA的GAD与抑郁症发病机制的关系等多个角度进行深入验证。
4 结论
本研究结果提示前额叶皮质GABA异常参与慢性应激诱导的抑郁发生,艾司西酞普兰可以扭转慢性应激诱导的抑郁样行为和焦虑样行为,并可扭转前额叶皮质的GABA异常。
本文无利益冲突。
参考文献 略
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






