初中化学酸碱盐反应规律(初中化学酸碱中和反应及PH简答题技巧大全)

加粗字体为高频考点
一、中和反应1.如何判断化学反应是否发生?⑴证明是否有新物质生成⑵混合在一起的物质,其中某一种是否被消耗。
2.探究氢氧化钠和盐酸能否发生反应实验:
实验步骤:⑴如图所示,在烧杯中加入10ml稀氢氧化钠溶液,滴入几滴酚酞溶液。再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止。

实验现象:红色酚酞溶液变成无色
实验分析:红色酚酞溶液变成无色,说明溶液不显碱性,说明氢氧化钠因与盐酸反应而被耗尽,说明反应发生。
3.中和反应定义:酸与碱作用生成盐和水的反应
注意:⑴反应物只能是酸与碱
⑵不属于基本反应类型
4.⑴中和反应微观实质:氢离子与氢氧根离子结合生成了水分子。
⑵结合图说出此中和反应的微观实质:

稀盐酸中的氢离子与氢氧化钠溶液中的氢氧根离子结合生成水分子。
5.盐:能解离出金属离子(或NH4 )和酸根离子的化合物
二、中和反应在实际中的应用1.改变土壤的酸碱性
根据土壤的情况,可以利用中和反应,在土壤中加入酸性或碱性物质,以调节土壤的酸碱性,以利于植物生长。
⑴酸性土壤中通常加碱性物质
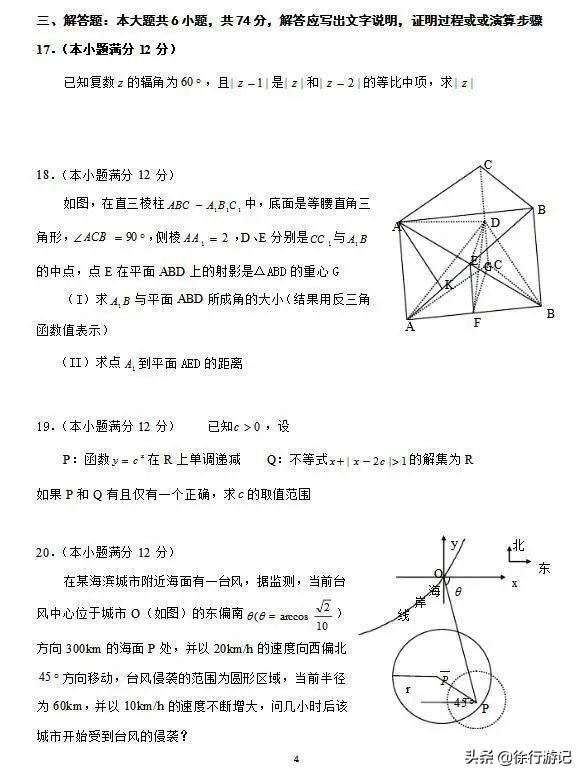
例如:酸雨导致土壤酸性增强,将适量的熟石灰加入土壤,以中和其酸性
⑵碱性土壤中通常加酸性物质,如碳酸水。
2.处理工厂的废水
⑴酸性废水加碱性物质
硫酸厂的污水中含有硫酸等,如何处理此废水?
可以加入适量熟石灰进行中和至中性,达标后排放。
反应原理:

⑵碱性废水加酸性物质:
印染厂的废水呈碱性,可加入硫酸进行中和至中性,达标后排放。
3.用于医药
⑴人体胃液里含有适量的盐酸,可以帮助消化。但是如果饮食过量时,胃液会分泌大量的胃酸,造成胃部不适以致消化不良,胃酸过多的人可以服用含碱性物质的药物,以中和过多的胃酸。
例如:氢氧化铝来治疗胃酸过多

4.用于生活
蚊虫叮咬后涂碱性物质的溶液的原因是:蚊虫叮咬后,蚊虫在人的皮肤内分泌蚁酸使叮咬处很快肿成大包而痛痒。如果涂一些碱性物质的溶液可以减轻痛痒,在家庭中可以用肥皂水、牙膏等涂抹可以迅速止痒。
三、简答题1.胃溃疡病人胃酸过多,服用哪种药物合适?为什么?
难溶性碱,如果服用含有碳酸盐的药物,会和胃酸反应生成二氧化碳气体,使胃内压强增大,易造成胃穿孔。
2.你如何使用洗发水和护发素?说出你的理由?(提示:洗发水显碱性、碱性腐蚀头发、护发素显酸性)
先用洗发水后用护发素
洗发水能将头发上的油污乳化而除去,但由于其呈碱性,会损伤头发。护发素呈酸性,能中和掉残留头发上的洗发水,使头发处于中性或弱酸性环境中,利于头发生长。
3.家庭用的厨房清洁剂显碱性,厕所清洁剂显酸性,有人认为将两者混合使用去污力会更强。你的看法是什么?
这种说法是不对的,厕所清洁剂显酸性,会中和显碱性的厨房清洁剂,影响去污能力。
4.用适量的稀盐酸可以将热水瓶胆壁上的水垢(主要成分是氢氧化镁和碳酸钙)除去,说明去垢的原理,写出有关反应的化学方程式。
水垢的主要成分是碳酸钙和氢氧化镁,它们能与盐酸反应生成可溶于水的氯化钙和氯化镁

5.有些胃药中含有氢氧化铝,它在人的胃内起什么作用?试写出反应的方程式。
中和胃内过多的胃酸

6.酸液倒入铸铁管道,危害:腐蚀管道,污染地下水
7.酸液不能倒入铸铁管道的原因:酸液与铸铁管道发生化学反应,使铸铁管道受腐蚀,并污染地下水。
8.治疗胃酸过多的药物中含有的成分是:
Mg(OH)2 Al(OH)3 CaCO3 NaHCO3
四、溶液酸碱度的表示法——pH1.酸碱性和酸碱度的区别
区别:溶液的酸碱性:表示溶液是酸性还是碱性的,属于一种性质。
溶液的酸碱度:表示溶液酸碱性的强弱程度
2.酸碱性和酸碱度的若知道了溶液的酸碱度,就能确定溶液的酸碱性。

pH<7溶液为酸性:pH越小酸性越强,pH=0酸性最强;
pH=7溶液为中性;
pH>7溶液为碱性,pH越大碱性越强,pH=14碱性最强。
3.改变溶液pH的方法:
①酸性溶液:加水,溶液pH值不断增大,最终接近于7;加碱性溶液,溶液pH值不断增大,最终pH值大于7
②碱性溶液:加水,溶液pH值不断减小,最近接近于7;加酸性溶液,溶液pH值不断减小,最终pH值小于7
③中性溶液:加水,pH值无变化
4.pH值的测定:
⑴最简单的方法是使用pH试纸
将一小块干燥的pH试纸放在玻璃片或白瓷板上,用玻璃棒蘸取待测液
在pH试纸上,将pH试纸显示的颜色和标准比色卡比较,读出该溶液的pH。
注意:A:用pH试纸测得的pH只能为正整数。
B:用pH试纸测pH时,不能先用蒸馏水润湿pH试纸。若先用蒸馏水润湿后再测会影响结果:使酸性的pH增大;使碱性的pH减小;中性溶液的pH不变。
C:pH试纸不能伸入待测液中,会污染试剂。
⑵通过电子仪器——pH计,把仪器的探棒放入溶液即可在显示屏上读取数据,该法精确度高
5.溶液酸碱度的重要意义
⑴化工生产中许多反应必须在一定的pH溶液里才能进行。
⑵在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长,在pH小于4的酸性土壤或pH大于8的碱性土壤中,一般不适于种植。调节土壤的pH是改良土壤的方法之一。
⑶某些工厂排放的酸性气体未经处理而排放到空气中,可能导致降雨的酸性增强,(正常雨水的pH约为5.6)我们把pH小于5.6的降雨叫酸雨,酸雨对农作物以及一些建筑等不利,随时监测雨水的pH可以了解空气的污染情况,以便于采取措施。
⑷健康人的体液必须维持在一定的酸碱度范围内,如胃液的pH值在0.9-1.5;如果出现异常,则可能导致疾病,测定人体内排出的液体的pH,可以帮助人们了解人体的健康状况。
⑸人体内的一些液体和排泄物的正常pH范围:
血浆 7.35-7.45 胃液0.9-1.5

下一篇文章 盐
上一篇文章地址
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com