虎纹蝾螈的生命历程(从蝾螈到克隆猴)
欢迎点击「中国科学报」↑关注我们!
BioArt按
公元1818年,玛丽·雪莱发表了科幻文学开山之作《弗兰肯斯坦》。200年过去了,幻想已一步步成为激动人心的现实。自1928年德国胚胎学家Hans Spemann成功获得第一例核移植动物,到今年中国科学家完成世界上第一例体细胞克隆猴,核移植科学走过了近百年的历程,它不仅回答了一系列重大的科学问题,而且在许多方面已投入到实际应用,造福人类。值此90周年之际,BioArt特邀中科院生物与化学交叉研究中心秦逸人博士撰写长文(并编绘图例),为我们梳理、解读核移植科学近百年的发展历程。

撰文 | 秦逸人(中科院生物与化学交叉中心)
责编 | 狄德罗
今年1月,中国科学家首次获得体细胞克隆猴。继Dolly羊诞生之后,这一研究再次将动物克隆推到了高潮,并成为民间热门话题。那么,到底什么是动物克隆呢?
“克隆”一词音译自英语单词“Clone”,意指无性繁殖,为不涉及生殖细胞、直接由母体分裂而形成新个体的繁殖方式。这在单细胞动物或者低等多细胞动物中普遍存在。而更为高级的动物均为有性生殖,即,新个体由雌雄配子结合的受精卵发育而来。有性生殖有利于让基因组合的广泛变异增加子代适应自然选择的能力。既然如此,为何我们要把更高级的生殖方式再返回到低等呢?又是通过什么方法做到的呢?
这是因为,有性生殖的发育过程非常复杂,科学家便利用无性生殖的“遗传一致性”特点,去搞清楚发育过程中的一系列科学问题。而实现无性生殖的方法便是核移植 (Nuclear Transfer)。核移植,顾名思义,就是将细胞核移植入另一种细胞的过程。这样说我们就明白了:称“克隆”较为通俗,而称“核移植”则更为专业。正逢核移植诞生90周年,为了让大家能更深入地了解核移植研究,笔者特撰文作图介绍核移植的重大科学发展史。
一、人造双胞胎动物的研究为核移植提供思想和实验基础
有性生殖动物均为雌雄配子结合的单细胞受精卵发育而来。然而,受精卵分裂后的胚胎卵裂球是否依然具备此能力呢?以下人造双胞胎动物实验研究便给了我们科学的解答。
第一例人造双胞胎动物
1885,海胆
1885年,德国生物学家Hans Driesch将棘皮动物门海胆 (无脊椎动物) 的2-细胞卵裂胚胎独立分离开来,发现他们能分别发育为独立的个体【1】,这是人类历史上第一例人造双胞胎动物,见图1。

图1:Driesch (A) 与其海胆2-cell胚胎分离实验模式图 (B,笔者绘制)
第一例人造双胞胎脊椎动物
1902,蝾螈
1902年,德国胚胎学家Hans Spemann在以上海胆实验基础上,将蝾螈2-细胞胚胎用发丝结扎,分离为2个独立的卵裂胚胎,发现其也能分别发育为独立的个体【2】。这是第一例人造双胞胎脊椎动物,见图2。此外,Spemann也分离了更后期的胚胎卵裂球,发现其不能发育到个体。

图2:Speman (A) 与其蝾螈2-cell胚胎分离实验模式图 (B,笔者绘制)
以上科学实验清晰地给我们回答了一个基本的科学问题:2-细胞胚胎时期的任何一个卵裂球均和受精卵一样,具备发育为一个个体的能力,而后期的卵裂球不再具备。
二、核移植的发展历程
第一例核移植动物
1928,蝾螈
1928年,Spemann在其上述实验基础上将蝾螈的受精卵不完全结扎,一半仅为胞质,另一半含有原核,直到有核的一半发育到16-cell胚胎时将结扎线去除,再挤压一个卵裂胚胎的细胞核进入到之前没有细胞核的胞质形成一个重构胚胎,最后将此胚胎分离出来,发现其可以发育为一个个体【2,3】,见图3。这是人类史上第一次核移植实验,它为我们回答了以下重大科学问题:1. 分裂后的胚胎细胞在受精卵胞质的作用下,可以完成一个个体的发育;2. 胚胎细胞核,而非胞质,指导胚胎的发育过程。另外,Spemann也推测:如果利用发育更晚期的胚胎细胞甚至一个个体的细胞核移植,可能会获得一个新个体。因以上原创性的贡献,Spemann于1935年荣膺诺贝尔生理医学奖【4】。

图3:Spemann的核移植实验过程 (模式图由笔者绘制)
第一例卵细胞诱导的核移植动物
1952,林蛙
1952年,英国科学家Robert Briggs 与Thomas Joseph King首次报道了以卵细胞为受体的核移植实验研究。他们的方法在Spemann的基础上做了很大的改进,发展了一个核移植程序 (见图4),至今仍在使用 。即,先去除林蛙 (Rana pipiens)的卵细胞核,再将分离的林蛙胚胎细胞核注射到去核卵细胞,获得重构胚胎。他们发现,尽管效率很低(同Spemann蝾螈核移植实验效率相比)——尤其是利用发育更晚期的胚胎细胞作为供体的时候——但这一重构胚胎仍然能够继续发育为一个个体【5】。该实验回答了以下重要科学问题:1. 细胞核直接指导细胞的生长和个体的发育;2. 早期胚胎细胞能更有效地用于核移植。
另外,该文献还报告了一项非常有趣的实验:他们将牛蛙 (Rana catesbeiana) 的胚胎细胞核移植入林蛙的去核卵,发现该重构胚胎能够发育到囊胚期,但随后停止发育,胚胎死亡。这可能是人类历史上第一次异种核移植实验。

图4:1952年Robert Briggs 与Thomas Joseph King发表在PNAS上报道的林蛙胚胎细胞核移植研究 (A) 与该研究实验模式图 (B,笔者绘制)。
第一例体细胞核移植动物
1958,非洲爪蟾
1958年,英国科学家John Gurdon在林蛙胚胎细胞核移植实验的基础上用非洲爪蟾 (Xenopus laevis) 幼体肠细胞核移植入去核卵细胞,发现该胚胎也能够发育为一个个体,而此个体的基因组与供体细胞的一致【6】,见图5。这是人类史上第一例体细胞核移植动物。它给我们回答了以下重大科学问题:1. 一个分化的细胞在一定条件下能够逆转进而再次发育为一个体;2. 一个细胞含有所有遗传物质,即便是其发生了分裂或者分化。因以上原创性的贡献,John Gurdon荣膺2012年诺贝尔生理医学奖。

图5: John Gurdon (A) 与其在1958年在Nature上发表的非洲爪蟾体细胞核移植研究。
第一例哺乳动物核移植胚胎
1975
因两栖类动物在体外受精,且卵细胞较大,很容易体外实验操作,而哺乳动物体内受精,卵细胞较小 (≈1000:1),在体外操作时有很大的难度。1975年,英国科学家J. Derek Bromhall发展了一套哺乳动物核移植实验程序:他利用煅烧拉制的细玻璃管进行操作,将兔的胚胎细胞核注射入去核卵母细胞,发现此重构胚胎能够发育到桑葚胚,这是首次获得哺乳动物核移植胚胎的报道【7】,见图6。此研究也预示了哺乳动物核移植也有可能获得个体。

图6:1975年J. Derek Bromhall以独立作者在Nature上发表的兔核移植实验研究。图中左下为兔卵细胞核移植操作过程,右下为发育到桑葚期的兔克隆胚胎。
第一例核移植哺乳动物
1986,绵羊
1986年,英国科学家Steen Willadsen将绵羊的8-cell胚胎的一个卵裂球分离出来,然后与一个去核卵母细胞进行电融合,形成一个重构胚胎,他们发现这一新的胚胎不仅能够体外继续发育,且在移植入受体子宫后继续发育,最后他们成功地获得了3只存活的羔羊【8】,见图7。本研究为人类第一次获得核移植哺乳动物,其说明了核移植操作在哺乳动物是切实可行的,尽管他们用早期胚胎细胞核作为供体,但是为哺乳动物体细胞核移植提供了实验依据。

图7:1986年Steen Willadsen以独立作者发表在Nature上的利用绵羊胚胎细胞核移植获得的克隆绵羊。
第一例核移植灵长类动物
1997,恒河猴
1997年,Li Meng与Don Wolf等人利用以上绵羊的核移植方法,首次开展了对灵长类动物核移植的研究。他们发现胚胎卵裂球与去核卵细胞形成的重构胚胎不仅能在体外进行卵裂发育,且移植入受体猴子宫后,成功获得了2只健康存活的个体【9】,见图8。这是第一例核移植灵长类动物,为体细胞克隆猴提供了实验依据。
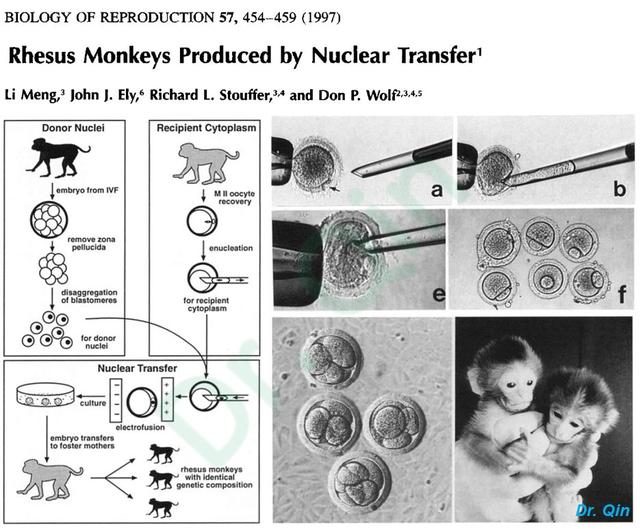
图8:1997年Li Meng与Don Wolf等利用恒河猴胚胎细胞核移植成功的获得2只克隆个体。
第一例体细胞核移植哺乳动物
1997,绵羊Dolly
1997年,Ian Wilmut与Keith Campbell等在胚胎细胞核移植绵羊的基础上,利用成年芬多斯母羊的乳腺上皮细胞与苏格兰黑面母羊的去核卵细胞进行电融合,获得重构胚胎,发现此重构胚胎能够体外继续发育至桑葚和囊胚期,然后他们将这些胚胎移植入受体羊子宫,成功地获得了1只存活的羔羊【10】,见图9。这是人类历史上的首个体细胞核移植克隆哺乳动物,科学家命名它为Dolly,其社会影响力巨大,也成为了家喻户晓的“明星”。

图9:1997年Ian Wilmut与Keith Campbell等在Nature上报道了利用成年绵羊乳腺母细胞核移植获得的克隆羊Dolly。
体细胞克隆哺乳动物俱乐部
1997~
自克隆羊Dolly诞生后,其他不同物种也被成功克隆,相继证实了体细胞核移植的可行性。截止目前,正式国际学术期刊报道的健康存活的体细胞克隆哺乳动物有以下19种:牛 (1998年)【11】、小鼠 (1998年)【12】、山羊 (1999年)【13】、猪 (2000年)【14】、欧洲盘羊 (2001年)【15】、家兔 (2002年)【16】、家猫 (2002年)【17】、马 (2003年)【18】、大鼠 (2003年)【19】、骡子 (2003年)【20】、非洲野猫 (2004年)【21】、狗 (2005年)【22】、雪貂 (2006年)【23】、狼 (2007年)【24】、水牛 (2007年)【25】、红鹿 (2007年)【26】、单峰骆驼 (2009年)【27】、以及最近的非人灵长类长尾猕猴 (2018年)【28】等,见图10。其中,水牛和猕猴完全由中国本土完成(分别为广西大学和中科院神经所),克隆大鼠和雪貂的主要完成人均为中国科学家 (论文第一作者),这说明我国在核移植研究领域处在国际领先地位。

图10:首次报道的体细胞克隆哺乳动物 (各动物照片均出自原始论文)。
从左往右、从上往下依次为:Dolly、牛、小鼠、山羊、猪、欧洲盘羊、家兔、家猫、非洲野猫、大鼠、雪貂、狗、狼、水牛、骡子、红鹿、单峰骆驼、马及长尾猕猴。
另外,有2个新的异种克隆物种存在异常,即克隆印度野牛【29】(家牛卵细胞,2000年) 与克隆双峰骆驼【30】(单峰骆驼卵细胞,2017年),前者在妊娠202天流产,后者在出生7天后死亡。
第一例冷冻死尸来源的克隆动物
2007,小鼠
2007年,日本科学家Teruhiko Wakayama(他首次报道获得了克隆小鼠【12】)等将完全没有冷冻保护剂的、-20℃冷藏16年的小鼠尸体成功地克隆复制【31】。在该项研究中,他们先尝试用死尸的各种不同组织分离的细胞核移植,发现只有大脑来源的细胞克隆胚胎体外发育和获得ESCs的效率最高。然后,再利用大脑细胞来源的核移植ESCs作为供体细胞核移植 (连续核移植),获得了4只克隆小鼠,其中2只具备正常生育功能,见图11。
这项突破性的研究给我们解答了以下重大问题:1. 长期冷藏的死亡个体即使其所有细胞也全部死亡,只要其遗传物质不降解,就可以被克隆复制。2. 为物种整个基因组的有效储存提供新的思路和方法;3. 为复活古生物提供思路和实验基础。

图11:2007年Teruhiko Wakayama等将完全没有冷冻保护的、在-20℃冷冻16年的小鼠尸体成功地克隆。
第一例体细胞核移植灵长类动物
2018,长尾猕猴
2018年,中科院神经科学研究所孙强与刘真等报道了利用食蟹猴胎儿皮肤成纤维细胞核移植,成功获得了2只健康的克隆个体,并命名为“中中”和“华华”【32】,见图12。这是人类史上第一次获得的体细胞克隆灵长类动物。因非人灵长类动物被认为是人类疾病最好的研究模型,利用克隆这一遗传一致性的特点便消除了传统模型猴的个体差异,故该项研究具有重大科学意义。
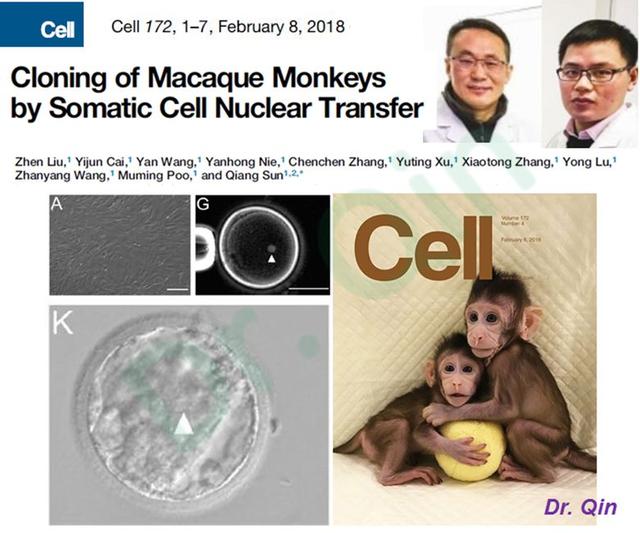
图12:2018年2月Cell以封面形式报道了中科院神经科学研究所孙强与刘真等利用食蟹猴胎儿皮肤成纤维细胞核移植获得的克隆猴“中中”和“华华”。
另外值得我们思考的是:从胚胎细胞移植绵羊 (1986) 到体细胞克隆羊Dolly (1997) 仅用了11年,但从胚胎细胞核移植猴 (1997) 到体细胞克隆猴却经历了21年,且利用成年个体体细胞 (卵丘细胞) 却没有获得成功。这充分地说明了最高级的灵长类动物的克隆并不像其他低等哺乳动物那样想想的简单,不仅需要更高的技术和难度,还需要更深入的科学探讨。故自克隆猴诞生后,我将体细胞克隆动物的发展进程分为了以下三个阶段 (见图13):第一阶段:自1958年开始报道的两栖类动物的体细胞克隆研究;第二阶段:自1997年开始报道的低等哺乳动物的体细胞克隆研究;第三阶段:自2018年开始报道的非人灵长类动物的体细胞克隆研究。
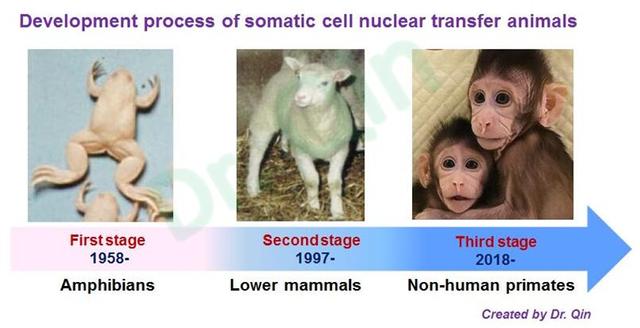
图13:体细胞克隆动物的发展进程可分三个阶段:1. 自1958年开始报道的两栖类动物克隆;2. 自1997年开始报道的低等哺乳动物克隆;3. 自2018年开始报道的非人灵长类动物克隆 (笔者所制)。
有人或许觉得,体细胞克隆猴不具有重大创新,只不过是换了物种的Dolly羊重复。那么Dolly算不算胚胎细胞核移植绵羊换了一种供体细胞呢?算不算体细胞核移植爪蟾换了一个物种呢?面对这些问题,我们可以在上述核移植的发展历程中找到答案:科学创新并不是没有基础的突发性飞跃,而是缓慢积累的循序式渐进;并不是来自没有依据的无知遐想和天马行空,而是来自对现有科学知识的批判和继承。
三、核移植在其他方面的重大科学突破
我们把上述利用核移植获得克隆动物的研究称为生殖性克隆,如克隆家畜、克隆宠物、拯救濒危物种、获得遗传一致的动物模型等。除此之外,利用核移植也可以研究其他重大科学问题,如获得病人来源的胚胎干细胞 (Embryonic Stem Cells, ESCs)、阻断线粒体疾病的下一代遗传、提高高龄妇女卵细胞质量、获得体外培养和遗传操作的“精子”、获得多倍体研究模型、研究基因组的稳定性、研究细胞重编程机制、解答表观遗传学的基础问题等等。下面就这方面所做出的重大成果进行阐述。
1. 治疗性克隆
治疗性克隆相对生殖性克隆而言,指的是体细胞克隆胚胎不移植入受体,而是在体外分离出干细胞的过程,我们将此干细胞称为核移植ESCs。如果利用病人来源体细胞核移植获得干细胞,就可以说是“量身定做”了,在理论上不存在免疫排斥,具有巨大的临床应用前景。在iPSCs (induced Pluripotent Stem Cells)【33】出现之前,核移植是能够将体细胞转变为二倍体多能干细胞的唯一方法,而iPSCs的出现为我们提供了另一种途径。这时治疗性克隆的研究开始放缓,主要是因为:第一,核移植研究的要求较高,不仅需要更复杂的实验设备,而且需要高超的实验技术;第二,人卵细胞的应用受到限制。
然而,在iPSCs 出现7年后,人核移植ESCs终于获得成功【34】,又一次将治疗性克隆提到了热点。尽管iPSCs具备更多的优势,如实验过程更加简捷和普及(如今商品化的iPS Kit能让最普通的实验室也能搞定)等,但核移植ESCs更接近于自然重编程和受精卵来源的ESCs【35】,且无基因修饰,临床应用可能更为安全可靠。故核移植ESCs与iPSCs可以进行优势互补来开展研究。下面我就概括一下治疗性克隆的发展历程和所取得的重大突破。
第一例体细胞核移植ESCs
2001
2001年,Teruhiko Wakayama等在其克隆小鼠的基础上,报道了在成年小鼠体细胞克隆胚胎中分离出了具备多能性特征的核移植ESCs【36】,见图14。这也是第一例体细胞核移植ESCs,为人核移植ESCs的研究提供了实验基础。

图14:2001年Teruhiko Wakayama等在Science报道了利用小鼠克隆胚胎分离出的ESCs。
第一例灵长类体细胞核移植ESCs
2007
2007年,美国Oregon国家灵长类研究中心的Shoukhrat Mitalipov等报道了在成年恒河猴皮肤成纤维细胞核移植的克隆胚胎中,成功地分离获得了2枚ESCs,其不仅有正常的核型,且具备体内外三胚层分化的多能性【37】,见图15。这是第一例灵长类体细胞核移植ESCs。

图15:2007年Shoukhrat Mitalipov等在Nature以封面文章报道了获得成年恒河猴皮肤来源的核移植ESCs。
第一例人体细胞核移植ESCs
2013
2013年,Shoukhrat Mitalipov等在其恒河猴核移植ESCs的基础上报道了利用人胎儿皮肤成纤维细胞核移植,在克隆胚胎中成功地获得了4枚有正常二倍体核型和具备多能性的核移植ESCs【34】,见图16。这是第一例获得的人核移植ESCs。随后,有更多的实验室也报道了获得正常成年人【38】、糖尿病【39】及老年性黄斑变性【40】病人体细胞来源的核移植ESCs,让治疗性克隆再一次成为热点。

图16:2013年Shoukhrat Mitalipov等在Cell上报道了利用人胎儿皮肤获得人核移植ESCs的研究。在以往基础上他们改进了研究方法,主要为利用高质量的卵细胞和咖啡因来提高效率。
2. 线粒体疾病的下一代预防
线粒体DNA (mitochondrial DNA, mtDNA) 突变引起的线粒体遗传病为母系遗传,通过卵细胞可以再传递给下一代,传统的辅助生殖方法无法做到预防,而核移植给我们提供了思路,即通过受精卵原核互换或患者卵细胞核 (或极体) 移植入健康去核卵细胞便可剔除突变的mtDNA,进而预防下一代的发病。不过利用此方法会使正常卵细胞捐献者的mtDNA传给患者的下一代,故通过这一方法获得的婴儿被认为存在1父2母的伦理问题。
第一例线粒体替代的灵长类动物
2009
2009年,Shoukhrat Mitalipov等报道了将猕猴的卵细胞纺锤体取出,移植入另一猕猴去核卵细胞的卵周隙,然后通过电融合的方法获得新的卵细胞。1-2小时后,在重构卵胞质中注入精子完成受精。最后将受精胚胎移植入受体子宫,成功产下2个健康的猕猴【41】,见图17。这是首例通过卵细胞核移植获得的线粒体替代灵长类动物,为人类线粒体疾病研究提供了实验基础。

图17:2009年Shoukhrat Mitalipov等在Nature上报道了通过猕猴卵细胞核移植获得的首例线粒体替代灵长类动物。
第一例线粒体替代婴儿
2017
2017年美国新希望生殖中心(私立机构)张进等正式详细地报道了(2006年的简短报道未透露细节)利用以上猕猴线粒体替代方法,将mtDNA突变的Leigh氏综合征携带者的卵细胞纺锤体移植入正常捐献者去核卵细胞构成一个新卵,再注入其丈夫的精子获得受精胚胎。对此胚胎进行遗传筛查后进行胚胎移植,成功地获得一个健康男婴【42】,见图18。这是世界上首例利用卵细胞核移植方法获得的“三亲婴儿”,但因伦理问题张进遭到美国FDA警告。

图18:2017年张进等正式报道了利用Leigh氏综合征携带者卵细胞纺锤体移植获得的健康婴儿。
3. 体外培养和遗传操作的“精子”
以上提及的研究方法均为在去核卵中注入胚胎细胞或体细胞或卵细胞核,如果注入一个精子会是什么结果呢?2012年中科院生物化学与细胞生物学研究所李劲松研究员 (笔者的博士后导师) 课题组与徐国良研究员课题组便合作报道了这样的研究【43】,即,在小鼠的去核卵细胞中注射一个精子,然后对其进行激活和培养,发现该重构胚胎不仅能体外发育到囊胚阶段,且能从该胚胎中分离出ESCs,然后通过FACS分选,成功地获得了单倍体细胞,称为孤雄单倍体ESCs;重要的是,将此细胞注入完整卵细胞中时,发现其和精子一样,发生受精并可发育为一个个体。另外,对此孤雄单倍体ESCs进行体外遗传修饰再受精后,也可获得遗传操作的小鼠,见图19。这是人类史上第一次将精子转变为能够体外长期培养和遗传操作的具备生殖功能的单倍体干细胞,具有重大的科学意义。该项研究也是国内生命科学领域为数不多的原创性突破。

图19:2012年李劲松与徐国良等在Cell上报道了利用核移植方法将精子转变为能在体外培养和基因修饰的且具备生殖功能的单倍体ESCs
结 语
自第一例核移植动物到第一例体细胞核移植灵长类,核移植研究恰好迎来90周年,在这接近百年的研究历程中,核移植不仅回答了一系列重大科学问题,且在许多方面已投入到了实际应用 (见图20)。
然而,核移植研究还有诸多问题亟待解决:
1. 体细胞核移植效率仍然很低,主要表现在:(1) 克隆动物出生率依然在5%以下 (临床IVF婴儿出生率≥50%),而目前体细胞克隆猴仅来自胎儿皮肤细胞,成年体细胞却无法获得;(2) 异种克隆几乎很难获得健康的个体;(3) 人核移植ESCs的效率也很低,目前仅有几家实验室才能做到。
2. 核移植的表观重编程机制了解甚少,目前的大部分研究停留在获得克隆个体的表象上,在机制方面深入探讨的研究却极少,这也是核移植效率得不到大幅提高的根本原因。如果这一问题得不到解决,体细胞克隆猴也很难作为普及的动物模型,而复制猛犸象也仅仅是人类的幻想;
3. 线粒体疾病的替代治疗存在伦理问题,这也是阻碍其临床广泛推广的主要原因。不过随着科学的进一步发展,作为一名核移植研究工作者,我相信以上问题会取得突破。

图20. 核移植大计事年表(以上时间均为正式期刊报道日期)。其中第一例核移植动物和第一例体细胞核移植动物的研究分别荣膺1935年与2012年诺贝尔奖 (Nobel Prize, NP) (笔者绘制)
后记
自2006年读博士研究生以来,笔者便开始了对核移植的研究,正逢核移植90周年,怀着崇敬而又激动的心情完成了此文,同时也为我将要写的另一篇英文Review做一铺垫。因从原始资料的收集整理到博文的构思撰写,再到所有图例的描绘制作,均由我一人完成,如有不足之处,敬请大家批评指正!
参考文献
[1] Wikipedia - Hans Driesch
[2] Wikipedia - Hans Spemann
[3] Bright Hub - The Scientific Experiments of Hans Spemann
[4] Nobel Prizes and Laureates: Hans Spemann – Biographical
[5] Briggs R, King TJ. Transplantation of Living Nuclei From Blastula Cells into Enucleated Frogs' Eggs. Proc Natl Acad Sci U S A. 1952 May;38(5):455-63.
[6] GURDON JB, ELSDALE TR, FISCHBERG M. Sexually mature individuals of Xenopus laevis from the transplantation of single somatic nuclei. Nature 1958 Jul 5;182(4627):64-5.
[7] Bromhall JD. Nuclear transplantation in the rabbit egg. Nature. 1975 Dec 25;258(5537):719-22.
[8] Willadsen SM. Nuclear transplantation in sheep embryos. Nature. 1986 Mar 6-12;320(6057):63-5.
[9] Meng L, Ely JJ, Stouffer RL, Wolf DP. Rhesus monkeys produced by nuclear transfer. Biol Reprod. 1997 Aug;57(2): 454-9.
[10] Wilmut I, Schnieke AE, McWhir J, Kind AJ, Campbell KH. Viable offspring derived from fetal and adult mammalian cells. Nature. 1997 Feb 27;385(6619):810-3.
[11] Cibelli JB, Stice SL, Golueke PJ, Kane JJ, Jerry J, Blackwell C, Ponce de León FA, Robl JM. Cloned transgenic calves produced from nonquiescent fetal fibroblasts. Science. 1998 May 22;280(5367):1256-8.
[12] Wakayama T, Perry AC, Zuccotti M, Johnson KR, Yanagimachi R. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature. 1998 Jul 23;394(6691):369-74.
[13] Baguisi A1, Behboodi E, Melican DT, Pollock JS, Destrempes MM, Cammuso C, Williams JL, Nims SD, Porter CA, Midura P, Palacios MJ, Ayres SL, Denniston RS, Hayes ML, Ziomek CA, Meade HM, Godke RA, Gavin WG, Overström EW, Echelard Y. Production of goats by somatic cell nuclear transfer. Nat Biotechnol. 1999 May;17(5):456-61.
[14] Polejaeva IA, Chen SH, Vaught TD, Page RL, Mullins J, Ball S, Dai Y, Boone J, Walker S, Ayares DL, Colman A, Campbell KH. Cloned pigs produced by nuclear transfer from adult somatic cells. Nature. 2000 Sep 7;407(6800):86-90.
[15] Loi P, Ptak G, Barboni B, Fulka J Jr, Cappai P, Clinton M. Genetic rescue of an endangered mammal by cross-species nuclear transfer using post-mortem somatic cells. Nat Biotechnol. 2001 Oct;19(10):962-4.
[16] Chesné P, Adenot PG, Viglietta C, Baratte M, Boulanger L, Renard JP. Cloned rabbits produced by nuclear transfer from adult somatic cells. Nat Biotechnol. 2002 Apr;20(4):366-9.
[17] Shin T, Kraemr D, Pryor J, Liu L, Rugila J, Howe L, Buck S, Murphy K, Lyons L, Westhusin M. A cat cloned by nuclear transplantation. Nature. 2002 Feb 21;415(6874):859. Epub 2002 Feb 14.
[18] Galli C, Lagutina I, Crotti G, Colleoni S, Turini P, Ponderato N, Duchi R, Lazzari G. Pregnancy: a cloned horse born to its dam twin. Nature. 2003 Aug 7;424(6949):635.
[19] Zhou Q, Renard JP, Le Friec G, Brochard V, Beaujean N, Cherifi Y, Fraichard A, Cozzi J.Generation of fertile cloned rats by regulating oocyte activation. Science. 2003 Nov 14;302(5648):1179. Epub 2003 Sep 25.
[20] Woods GL, White KL, Vanderwall DK, Li GP, Aston KI, Bunch TD, Meerdo LN, Pate BJ. A mule cloned from fetal cells by nuclear transfer. Science. 2003 Aug 22;301(5636):1063. Epub 2003 May 29.
[21] Gómez MC1, Pope CE, Giraldo A, Lyons LA, Harris RF, King AL, Cole A, Godke RA, Dresser BL. Birth of African Wildcat cloned kittens born from domestic cats. Cloning Stem Cells. 2004;6(3):247-58.
[22] Lee BC, Kim MK, Jang G, Oh HJ, Yuda F, Kim HJ, Hossein MS, Kim JJ, Kang SK, Schatten G, Hwang WS. Dogs cloned from adult somatic cells. Nature. 2005 Aug 4;436(7051):641.
[23] Li Z, Sun X, Chen J, Liu X, Wisely SM, Zhou Q, Renard JP, Leno GH, Engelhardt JF. Cloned ferrets produced by somatic cell nuclear transfer. Dev Biol. 2006 May 15;293(2):439-48. Epub 2006 Apr 3.
[24] Kim MK, Jang G, Oh HJ, Yuda F, Kim HJ, Hwang WS, Hossein MS, Kim JJ, Shin NS, Kang SK, Lee BC. Endangered wolves cloned from adult somatic cells. Cloning Stem Cells. 2007 Spring;9(1):130-7.
[25] Shi D, Lu F, Wei Y, Cui K, Yang S, Wei J, Liu Q.Buffalos (Bubalus bubalis) cloned by nuclear transfer of somatic cells. Biol Reprod. 2007 Aug;77(2):285-91. Epub 2007 May 2.
[26] Berg DK1, Li C, Asher G, Wells DN, Oback B. Red deer cloned from antler stem cells and their differentiated progeny. Biol Reprod. 2007 Sep;77(3):384-94. Epub 2007 May 23.
[27] Wani NA, Wernery U, Hassan FA, Wernery R, Skidmore JA. Production of the first cloned camel by somatic cell nuclear transfer. Biol Reprod. 2010 Feb;82(2):373-9. Epub 2009 Oct 7.
[28] Liu Z, Cai Y, Wang Y, Nie Y, Zhang C, Xu Y, Zhang X, Lu Y, Wang Z, Poo M, Sun Q. Cloning of Macaque Monkeys by Somatic Cell Nuclear Transfer. Cell. 2018 Feb 8;172(4):881-887.e7. Epub 2018 Feb 1.
[29] Lanza RP, Cibelli JB, Diaz F, Moraes CT, Farin PW, Farin CE, Hammer CJ, West MD, Damiani P. Cloning of an endangered species (Bos gaurus) using interspecies nuclear transfer. Cloning. 2000;2(2):79-90.
[30] Wani NA, Vettical BS, Hong SB. First cloned Bactrian camel (Camelus bactrianus) calf produced by interspecies somatic cell nuclear transfer: A step towards preserving the critically endangered wild Bactrian camels. PLoS One. 2017 May 17;12(5):e0177800.
[31] Wakayama S, Ohta H, Hikichi T, Mizutani E, Iwaki T, Kanagawa O, Wakayama T.Production of healthy cloned mice from bodies frozen at -20 degrees C for 16 years. Proc Natl Acad Sci U S A. 2008 Nov 11;105(45):17318-22. Epub 2008 Nov 3.
[32] Liu Z, Cai Y, Wang Y, Nie Y, Zhang C, Xu Y, Zhang X, Lu Y1, Wang Z, Poo M, Sun Q. Cloning of Macaque Monkeys by Somatic Cell Nuclear Transfer. Cell. 2018 Feb 8;172(4):881-887. Epub 2018 Feb 1.
[33] Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 2006 Aug 25;126(4):663-76. Epub 2006 Aug 10.
[34] Tachibana M, Amato P, Sparman M, Gutierrez NM, Tippner-Hedges R, Ma H, Kang E, Fulati A, Lee HS, Sritanaudomchai H, Masterson K, Larson J, Eaton D, Sadler-Fredd K, Battaglia D, Lee D, Wu D, Jensen J, Patton P, Gokhale S, Stouffer RL, Wolf D, Mitalipov S. Human embryonic stem cells derived by somatic cell nuclear transfer. Cell. 2013 Jun 6;153(6):1228-38. Epub 2013 May 15.
[35] Ma H, Morey R, O'Neil RC, He Y, Daughtry B, Schultz MD, Hariharan M, Nery JR, Castanon R, Sabatini K, Thiagarajan RD, Tachibana M, Kang E, Tippner-Hedges R, Ahmed R, Gutierrez NM, Van Dyken C, Polat A, Sugawara A, Sparman M, Gokhale S, Amato P, Wolf DP, Ecker JR, Laurent LC, Mitalipov S. Abnormalities in human pluripotent cells due to reprogramming mechanisms. Nature. 2014 Jul 10;511(7508):177-83. Epub 2014 Jul 2.
[36] Wakayama T, Tabar V, Rodriguez I, Perry AC, Studer L, Mombaerts P. Differentiation of embryonic stem cell lines generated from adult somatic cells by nuclear transfer. Science. 2001 Apr 27;292(5517):740-3.
[37] Byrne JA, Pedersen DA, Clepper LL, Nelson M, Sanger WG, Gokhale S, Wolf DP, Mitalipov SM. Producing primate embryonic stem cells by somatic cell nuclear transfer. Nature. 2007 Nov 22;450(7169):497-502. Epub 2007 Nov 14.
[38] Chung YG, Eum JH, Lee JE, Shim SH, Sepilian V, Hong SW, Lee Y, Treff NR, Choi YH, Kimbrel EA, Dittman RE, Lanza R, Lee DR. Human somatic cell nuclear transfer using adult cells. Cell Stem Cell. 2014 Jun 5;14(6):777-80. Epub 2014 Apr 17.
[39] Yamada M, Johannesson B, Sagi I, Burnett LC, Kort DH, Prosser RW, Paull D, Nestor MW, Freeby M, Greenberg E, Goland RS, Leibel RL, Solomon SL, Benvenisty N, Sauer MV, Egli D. Human oocytes reprogram adult somatic nuclei of a type 1 diabetic to diploid pluripotent stem cells. Nature. 2014 Jun 26;510(7506):533-6. Epub 2014 Apr 28.
[40] Chung YG, Matoba S, Liu Y, Eum JH, Lu F, Jiang W, Lee JE, Sepilian V, Cha KY, Lee DR, Zhang Y. Histone Demethylase Expression Enhances Human Somatic Cell Nuclear Transfer Efficiency and Promotes Derivation of Pluripotent Stem Cells. Cell Stem Cell. 2015 Dec 3;17(6):758-766. Epub 2015 Oct 29.
[41] Tachibana M, Sparman M, Sritanaudomchai H, Ma H, Clepper L, Woodward J, Li Y, Ramsey C, Kolotushkina O, Mitalipov S. Mitochondrial gene replacement in primate offspring and embryonic stem cells. Nature. 2009 Sep 17;461(7262):367-72. doi: 10.1038/nature08368. Epub 2009 Aug 26.
[42] Zhang J, Liu H, Luo S, Lu Z, Chávez-Badiola A, Liu Z, Yang M, Merhi Z, Silber SJ, Munné S, Konstantinidis M, Wells D, Tang JJ, Huang T. Live birth derived from oocyte spindle transfer to prevent mitochondrial disease. Reprod Biomed Online. 2017 Apr;34(4):361-368.
[43] Yang H, Shi L, Wang BA, Liang D, Zhong C, Liu W, Nie Y, Liu J, Zhao J, Gao X, Li D, Xu GL, Li J. Generation of genetically modified mice by oocyte injection of androgenetic haploid embryonic stem cells. Cell. 2012 Apr 27;149(3):605-17.
(来源:公众号“BioArt”)
转载本文请联系原作者获取授权,同时请注明本文来自秦逸人科学网博客。
链接地址:http://blog.sciencenet.cn/blog-273948-1108210.html
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






