高考电解池电极反应书写方法(高考必考内容原电池中的电极反应式的书写典型例题)
原电池中电极反应式的书写是高考必考内容,主要考查原电池中的氧化还原反应原理。
原电池负极发生氧化反应,正极发生还原反应,电子从负极流向正极,溶液(或熔融态)中阳离子移向正极,阴离子移向负极。书写电极反应式时要注意电荷守恒。
一.电解质溶液中电极反应式的书写由反应和生成物的化合价判断正负极。元素化合价升高的物质被氧化,作原电池的负极;元素化合价降低的物质被还原,作原电池的正极。化合价变化的数值就是原子得失电子数目。同时要注意溶液的酸碱性,即酸性溶液中不能出现OH-,碱性溶液中不能出现H 。
典例1高铁电池具有比能量高、无污染的特点,用如图模拟其工作原理(放电时两电极均有稳定的金属氢氧化物生成),下列有关说法中正确的是
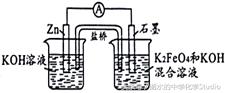
A. 放电时,电子由正极通过外电路流向负极
B. 放电时,负极上的电极反应式为:Zn-2e ─ 2H2O = Zn(OH)2 2H
C. 充电时,阴极区溶液的pH减小
D. 放电时,正极上的电极反应式为:FeO42 ─-3e ─ 4H2O=F e(OH)3 5OH ─
分析:从电池中给出的物质可判断:Zn发生氧化反应,为电池的负极,K2FeO4发生还原反应作电池的正极。根据题目中的信息:放电时两电极均有稳定的金属氢氧化物生成,结合电解质溶液为碱性,可写出正负极电极反应式。

分析:解答原电池问题,首先要确定原电池的正负极。CO、H2在A极氧化为CO2、H2O,A极为负极,O2被还原,B极是正极.
解析:反应中碳元素由-4价升高到 2价,每消耗1摩尔甲烷,转移6摩尔电子,A错误;电解质为熔融的碳酸盐,不含氢氧根离子,正确的电极反应式为: H2 CO32—-2e- ==CO2 H2O,B错误;B极通入氧气为正极,碳酸根离子向负极移动,C错误;电极B上氧气得到电子生成碳酸根离子,电极反应为: O2+2CO2+4e-=2CO32- ,D正确。
三.从题图中信息突破电极反应式的书写对于题目中给出示意图的,要根据题目中的叙述结合示意图,特别是图中箭头指示的方向,什么微粒进去,在电极上转化成什么微粒离开,从微粒中元素化合价,判断电极上发生的是氧化反应还是还原反应,进而判断电极反应式。如果示意图中标出了使用的是质子交换膜,则说明该原电池是酸式电池,那么电极反应式中就不能出现OH-。
典例3硼氢化钠(NaBH4)一过氧化氢燃料电池示意图。该电池工作时下列说法正确的是

A.电池工作时,Na 向A极移动
B.放电时,A极反应式为:BH4--8e- 8OH-=BO2- 6H2O
C.放电时A极附近溶液的pH增大
D.放电时,B极电极反应式为:H2O2 2e- 2H =2H2O
分析:从示意图可判断,该原电池是碱性硼氢化钠(NaBH4)一过氧化氢燃料电池,BH4-中氢元素的化合价由-1价升高到 1价,在A发生氧化反应生成BO2-,A极是负极;H2O2中氧元素由-1价降低到-2价,在B极发生还原反应生成OH-,B极是正极。
解析:原电池工作时,阳离子移向正极,A错误;放电时BH4在A极被氧化为BO2—,根据化合价变化、电荷守恒、原子守恒,且电解质溶液显碱性,A极反应式为:BH4-8e 8OH- == BO2- 6H2O,B正确;从A极电极反应式分析得出,放电时A极附近溶液的c(OH-)减小,溶液pH减小,C错误;由示意图判断,放电B极电极反应式为H2O2 2e- =2OH-,D错误
原电池中电极反应式的书写,首先要根据发生变化的物质中,元素化合价是升高还是降低,元素化合价升高发生氧化反应,是原电池的负极;元素化合价降低发生还原反应,是原电池的正极,再根据元素化合价的变化,标出元素得失电子数。一般的电解质水溶液,要分析清楚是酸性溶液还是碱性溶液,酸性溶液中不能出现OH-,碱性溶液中不能出现H 。熔融盐(或氧化物)作电解质的原电池,反应中不能出现H 或OH-。对于题目中示意图的,一定要看清微粒的变化
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






