化学九年级酸碱盐中考知识点(中考化学酸碱盐)


最近许多同学向大师要酸碱盐的知识,小伙伴们久等啦,今天大师就给大家准备了干货,初中化学酸碱盐知识点汇总,大家可要好好的学习哦~


一、酸及酸的通性
酸的定义,电离时生成的阳离子全部都是H 。酸是由氢离子和酸根离子构成。
1、浓盐酸、浓硫酸的物理性质、特性、用途.

2.酸的通性:盐 酸 HCl 硫酸 H2SO4
酸使紫色石蕊试液变红,使无色酚酞试液不变色。
金属 酸→盐 氢气Zn 2HCl=ZnCl2 H2↑Zn H2SO4=ZnSO4 H2↑
碱性氧化物 酸→盐 水Fe2O3 6HCl=2FeCl3 3H2OFe2O3 3H2SO4=Fe2(SO4)3 3H2O
碱 酸→盐 水NaOH HCl=NaCl H2OCu(OH)2 H2SO4=CuSO4 2H2O
盐 酸→另一种盐 另一种酸AgNO3 HCl=AgCl↓ HNO3BaCl2 H2SO4=BaSO4↓ 2HCl
注意:(1)在‘金属 酸→盐 氢气’中,酸通常指的是稀硫酸和稀盐酸,不能是浓硫酸或硝酸。因为浓硫酸或硝酸都有强氧化性,与金属反应时不能生成氢气而生成了水;指在金属活动顺序表中排在‘氢’前面的活泼金属排在‘氢’后不能置换酸中的氢。
(2)通过金属跟酸的反应情况导出金属活动顺序表:
K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au
金属活动性由强逐渐减弱金属活动性顺序中,金属位置越靠前,活动性越强,反应越剧烈,所需时间越短。
(3)浓硫酸具有吸水性,通常用它作为干燥剂。硫酸还具有脱水性,它对皮肤或衣服有很强的腐蚀性。稀释浓硫酸时一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,切不可把水倒进浓硫酸里,如果把水注入浓硫酸里,水的密度较小,会浮在硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液向四处飞溅,容易发生事故。

二、碱及碱的通性
定义:电离时生成的阴离子全部是OH-离子。碱是由金属离子(或铵根离子)和氢氧根离子构成。
1、氢氧化钠、氢氧化钙的物理性质、用途

2.碱的通性
碱使紫色石蕊试液变蓝,使无色酚酞试液变红。氢氧化钠使紫色石蕊试液变蓝,无色酚酞试液变红。氢氧化钙使紫色石蕊试液变蓝,无色酚酞试液变红。
酸性氧化物 碱→盐 水2NaOH CO2=Na2CO3 H2OCa(OH)2 CO2=CaCO3↓ H2O
酸 碱→盐 水NaOH HCl=NaCl H2OCa(OH)2 H2SO4=CaSO4 2H2O
盐 碱→另一种盐 另一种碱2NaOH CuSO4=Na2SO4 Cu(OH)2↓
注意:(1)只有可溶性碱才能跟一些非金属氧化物发生反应,这些非金属氧化物是酸性氧化物。酸性氧化物多数能溶于水,跟水化合生成酸。
(2)盐和碱反应时,必须两者都是可溶的,且生成物之一是沉淀,反应才能进行。
(3)书写碱跟某些金属氧化物反应的化学方程式
关于这类反应化学方程式的书写有人感到很困难,为此,可先写出非金属氧化物跟水反应,生成含氧酸的化学方程式,再以含氧酸和碱相互交换成分写出生成物。两式合并成一个化学方程式。如,三氧化硫跟氢氧化钠反应:

三、常见的盐及盐的性质
1、常见的盐 定义:能解离出金属离子(或NH4 )和酸根离子的化合物。
注:此时的盐不是指食盐,食盐的主要成分是NaCl。

2、精盐提纯——去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。
(1)、实验步骤:溶解、过滤、蒸发
(2)、实验仪器

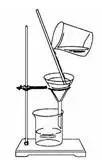

过滤 蒸发
注意:①蒸发皿是可以直接加热的仪器,液体体积不能超过蒸发皿2/3.
② 溶解时用玻璃棒搅拌,目的是加快溶解。
③ 加热时用玻璃棒搅拌,防止局部温度过高造成液滴飞溅
④ 待蒸发皿中出现较多固体时停止加热,利用余热使滤液蒸干,不能将滤液完全蒸干才停对于止加热。
3.盐的化学性质:
盐溶液 金属→盐ˊ 金属ˊCuSO4 Zn=ZnSO4 Cu
盐 酸→盐ˊ 酸ˊBaCl2 H2SO4=BaSO4↓ 2HCl
盐溶液 碱溶液→盐ˊ 碱ˊ3NaOH FeCl3=3NaCl Fe(OH)3↓
盐溶液 盐溶液→盐ˊ 盐ˊAgNO3 NaCl=AgCl↓ NaNO3
注意:在金属活动顺序表中,只有排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来。但K、Ca、Na三种金属与盐溶液的反应特殊,这里不要求。

四、明确复分解反应
发生的本质
1.复分解反应及其发生的条件
复分解反应的定义是:由两种化合物相互交换成分,生成另外两种化合物的反应。
通式:AB CD=AD CB
发生的条件:两种物质在溶液中相互交换离子,生成物中如果有沉淀析出、气体放出或有水生成,复分解反应均可以发生。
2.碱与酸性氧化物反应不属于复分解反应

五、熟记酸、碱、盐的溶解性
酸、碱、盐的溶解性记忆口诀:碱中氨、钾、钠、钡、钙可溶
钾钠铵盐硝酸盐,全部都属可溶盐。
硫酸盐不溶钡和铅;氯化物不溶银亚汞,碳酸盐除钾钠铵溶,其它不溶。

六、几个常见离子的检验
1.Cl-离子的检验
实验操作实验现象 实验结论化学方程式
取少量样品于试管中,滴加AgNO3溶液和稀HNO3有不溶于稀硝酸的白色沉淀生成样品含有Cl- AgNO3 KCl=AgCl↓ KNO3
2.SO42-离子的检验:取少量样品于试管中,滴加Ba(NO3)2溶液和稀HNO3有不溶于稀硝酸的白色沉淀生成样品含有SO42- Ba(NO3)2 H2SO4=BaSO4↓ 2HNO3
3. CO32-离子的检验:取少量样品于试管中,滴加稀HCl,将生成的气体通入澄清石灰水有无色气体生成,该气体使澄清石灰水变浑浊样品含有CO32-
K2CO3 2HCl=2KCl CO2↑ H2O CO2 Ca(OH)2=CaCO3↓ H2O
4、检验NH4+:取少量待检物于洁净的试管中,滴入适量NaOH溶液并加热,有使湿的红色石蕊试纸变成蓝色的气体产生。
5、鉴别稀盐酸和稀硫酸——分别取少量待检液体于两支洁净的试管中,各滴入几滴BaCl2溶液,有白色沉淀产生的原溶液是稀硫酸,无现象产生的原溶液是稀盐酸。

七、熟记常见元素、
原子团的化合价口诀:
(正价)一氢钾钠银,二钙镁钡锌,三铝、四硅、五氮磷。
(负价)负一价:氟、氯、溴、碘;负二价:氧和硫。(可变正价):一二铜汞,二三铁,二四碳,四六硫。
(原子团的化合价)
负一价:氢氧根(OH),硝酸根(NO3),氯酸根(ClO3),高锰酸根(MnO4);
负二价:硫酸根(SO4),碳酸根(CO3),亚硫酸根(SO3),锰酸根(MnO4);
负三价:磷酸根(PO4);正一价:铵根(NH4)。

八、熟记常见物质的俗称、
主要成分和化学式
生石灰——CaO 熟石灰——Ca(OH)2石灰石、大理石——CaCO3食盐——NaCl火碱、烧碱、苛性钠——NaOH纯碱、苏打——Na2CO3小苏打——NaHCO3铁锈、赤铁矿——Fe2O3赤铁矿——Fe3O4 金刚石、石墨——C 干冰——CO2冰——H2O
天然气(甲烷)——CH4酒精(乙醇)——C2H5OH醋酸(乙酸)——CH3COOH

九、常见物质的颜色
红色的固体——Cu、Fe2O3、P(红磷)
黑色的固体——C、CuO、Fe3O4、FeO、MnO2
白色的固体——KClO3、P2O5、P(白磷)、CuSO4(无水硫酸铜)、KCl、NaCl等
暗紫色的固体——KMnO4黄色的固体——S
蓝色的固体——CuSO4•5H2O蓝色沉淀——Cu(OH)2
红褐色沉淀——Fe(OH)3常见不溶于酸的白色沉淀——BaSO4、AgCl
溶于酸并放出使澄清石灰水变浑浊的气体的白色沉淀——BaCO3、CaCO3溶于酸但不产生气体的白色沉淀——Mg(OH)2、Al(OH)3等不溶性碱的沉淀
蓝色的溶液——CuSO4、CuCl2、Cu(NO3)2等含Cu2+溶液
浅绿色的溶液——FeSO4、FeCl2等含Fe2+溶液
黄色的溶液——FeCl3、Fe2(SO4)3、Fe(NO3)3等含Fe3+溶液

补充下列反应方程式:
1、氢氧化铜跟稀盐酸反应:Cu(OH)2 2HCl = CuCl2 2H2O蓝色沉淀消失
2、氢氧化铜跟稀硫酸反应:Cu(OH)2 H2SO4= CuSO4 2H2O变成蓝色溶液
3、氢氧化钠跟硫酸铜溶液反应:2NaOH CuSO4= Na2SO4 Cu(OH)2↓ 有蓝色沉淀产生
4、氢氧化钠跟氯化铁溶液反应:3NaOH FeCl3 =Fe(OH)3↓ 3NaCl 有红褐色沉淀产生
判断溶液的酸碱性——用指示剂,溶液的酸碱度——用pH来表示。

干燥剂的选择
1、浓硫酸可干燥:酸性气体(如:CO2、SO2、SO3、NO2、HCl、)中性气体(如:H2、O2、N2、CO) ※不能干燥碱性气体(如:NH3)
2、氢氧化钠固体、生石灰、碱石灰可干燥:碱性气体(如:NH3)
中性气体(如:H2、O2、N2、CO)※不能干燥酸性气体(如:CO2、SO2、SO3、NO2、HCl、)
3、无水硫酸铜固体遇水由白色变蓝色,可检验水的存在,并吸收水蒸气。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






