为什么氯气强氧化性弱(关于氧气和氯气氧化性强弱的探讨)
氧气和氯气哪个氧化性强 ?这个问题不指明具体环境和反应物的话一点意义都没有。因为根据环境和反应物的不同,氧气和氯气的氧化性顺序也不一样。
怎样衡量氧化性强弱?只有一条规则,就是强的氧化剂和还原剂反应,生成了较弱的氧化剂(氧化产 物)和还原产物。单质氧化性强弱与元素电负性等性质无绝对联系,与氧化产物的中心元素价态也没有直 接联系。氯气和氧气的氧化性与氯氧化物中的元素价态更加没有半毛钱联系。
如果仅从气相中分子得电子变成简单离子来看,氧气的得电子能力要大大低于氯气。因为氧气不仅要克服双键的较大键能(键焓 O=O:498kJ/mol,Cl-Cl:243kJ/mol),而且还要成为二价的负离子,而一 价负离子得电子是要吸收能量的(氧第一电子亲和能(正值为放热,下同):140kJ/mol 第二电子亲和能: -780kJ/mol 氯电子亲和能:348.8kJ/mol。为什么氯的第一电子亲和能也比氧大?简单地说,就是 17 电荷的氯核管 18 个电子比 8 电荷的氧核管 9 个电子容易),所以氧气得到电子变为简单二价氧离子是要吸热的,而相对氯气得电子变为氯离子是放热的。两者能量相差很大。
O2 4e-=2O2- ΔH= 1138kJ/mol
Cl2 2e-=2Cl- ΔH=-105.8kJ/mol
所以在气相中有 2Cl2 2O2-=4Cl- O2 ,氯气氧化性强。
由于一般的气相反应不形成离子,所以仅从得电子这方面不能有效衡量两者的氧化性。而两者在溶液中与其它物质发生氧化还原反应,氧化性不仅和键能有关,而且和溶剂化程度有关。氧离子电荷高,半径小,溶解热显著,但是离子化时的能量差距太大了,水合热补不回得电子时的差距,所以在水溶液中一般 是氯气氧化性强,可以由电极电势看出(φ(Cl2/Cl-)=1.36V φ(O2/OH-)=0.40V φ(O2/H2O)=1.23V)。氯气可以氧化水放出氧气:2Cl2 2H2O=4HCl O2,只是由于氯气溶于水的动力学稳定性,在没有光的作用下反应进行得很慢。
水溶液中的氧化性也会随着反应物和生成物的不同而不同,比如银作为还原剂能提高氯气的氧化性, 大量的氯离子会降低氯气氧化性,而氢离子会提高氧气的氧化性。但不幸的是,氯气和氧气的电极电势差距仍然很大,就算加上这些条件,氧气氧化性也难以超过氯气。
然而屌丝终有逆袭日,脱离水溶液就不同了。对于很多非金属性较强的元素,它们的氧化物通常比氯 化物要稳定。原因有:1 氧离子电荷高,半径小,与同样半径小电荷高的阳离子结合的晶格能高;2 氧在分 子中可以成双键或共轭大π键结构,在中心原子相同配位数的情况下能形成更多的化学键,降低能量。下面给出前 33 号元素常温下比较稳定的氯化物和氧化物的生成自由能。生成自由能是单质间反应能力强弱的一个标度,生成自由能越负,化合物的能量越低。若氧化物的生成自由能低于氯化物的,说明常温下氧气可以置换出该氯化物中的氯生成氧化物和氯气。若生成自由能为正,表明常温下该化合物不能通过稳定单质间的化合生成。
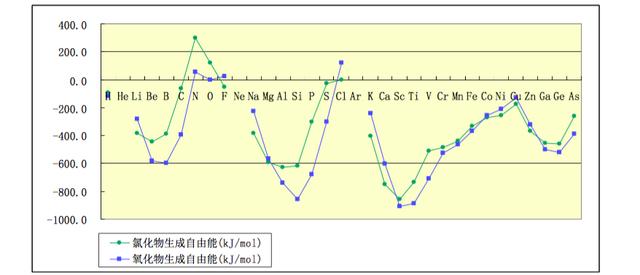
从图上可以看出,除了 s 区金属和一些过渡系金属,以及氯、氟,其它元素常温稳定的氧化物比氯化物要稳定,即氧化这些元素单质时,氧气氧化性强于氯气。
一般来说,若直接化合生成高价态的物质,几乎全是氧气的氧化性强。例如:SiCl4 O2=SiO2 2Cl2的反应在常温下是自发的,在这种情况下氧气氧化性比氯气强很多。顺带一提,将这些没有氧化物稳定的氯化物溶于水,一般都会剧烈水解产生氧化物或含氧酸,这个过程放出的能量就是水溶液中和纯物质反应时氯气氧气氧化性不同的原因。
这些反应中氯气氧化性也弱于氧气(不确定这些反应是否在动力学上发生,但它们在常温是自发的): SO2Cl2(g) 12 O2(g)=SO3(g) Cl2(g) ΔG= -51.0kJ/mol
PCl5(g) 12 O2(g)=POCl3(g) Cl2(g) ΔG= --207.9kJ/mol
所以氯气和氧气哪个氧化性强需要看环境和反应物,单纯说哪种氧化性强是片面的。而使用价态或元素电负性来判断则是毫无依据的。
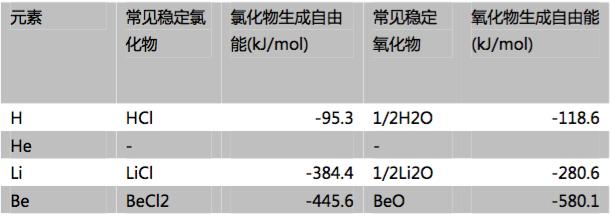
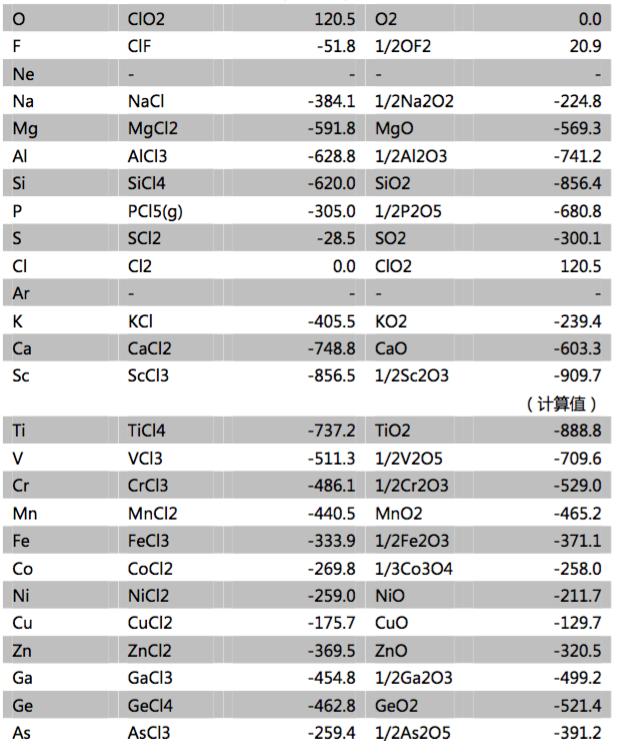
附:图表中使用的氯化物及氧化物的化学式及其生成自由能(来源:兰氏化学手册中文版第二版):

免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






