乳腺癌her2 1+是什么意思(乳腺新语乳腺癌HER2低表达的真真假假)
编者按:近日,T-DXd治疗晚期HER2低表达乳腺癌的3期DESTINY-Breast04研究已达到主要终点,将继续改写HER2乳腺癌的治疗格局。该研究主要纳入HER2 IHC 1 和IHC 2 且ISH-的患者,对于HER2 IHC零表达的治疗仍待进一步探索。近日,FeRNAndez等人发表于JAMA oncology的一项研究显示,应用当前的免疫组化检测进行HER2 1 和HER2 0的区分,其一致性较差。斯坦福大学医学中心病理学教授Kimberly H. Allison及霍普金斯大学金梅尔癌症中心肿瘤学教授Antonio C. Wolff认为,随着HER2低表达相关药物临床试验的的开展,将进一步推动HER2治疗格局和检测标准的变革。

乳腺癌组织HER2低表达检测
T-DXd对HER2低表达(IHC 2 且ISH−或IHC 1 )乳腺癌具有抗肿瘤活性,目前相关的大规模随机临床试验正在进行中。当前的大多数研究并没有纳入IHC 0的患者,利用免疫组化是否能够准确区分HER2 1 和0的患者?该研究旨在确定IHC对选择HER2低表达患者进行T-DXd治疗的适用性。
研究人员分析了来自美国病理医师学院(CAP)2019~2020年全球1391~1452个实验室每年各40次粗针穿刺活检HER2免疫组织化学评分(每年2次20次粗针穿刺活检,共计80次)的问卷调的数据,以及耶鲁大学18位病理医师对170份乳腺癌活检标本读片的一致性分析。
结果显示,CAP调查数据显示18.75%(15/80)的病例由实验室读片得出HER2 IHC 0与1 一致率≤70%。耶鲁大学18位病理医师阅片的IHC 0和1 一致率仅26%,而2 和3 一致率为58%。
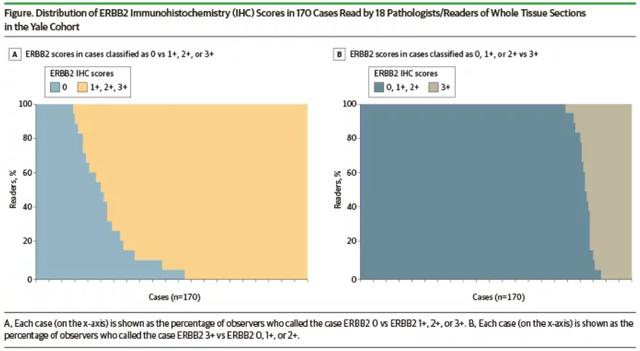
该研究结果表明,采用当前标准的HER2免疫组织化学评分来区分0和1 的准确性较差,这种准确性在真实世界中可能导致许多患者被错误分配是否接受T-DXd治疗。
乳腺癌HER2低表达的虚实真假
针对上述研究,斯坦福大学医学中心病理学教授Kimberly H. Allison及霍普金斯大学金梅尔癌症中心肿瘤学教授Antonio C. Wolff同期发表题为“ERBB2-Low Breast Cancer—Is It a Fact or Fiction, and Do We Have the Right Assay?”的社评文章。

专家指出,当前临床实践中常用的IHC并非定量分析,人们对HER2低表达水平的鉴别能力有限;有些情况下的IHC 0可能是福尔马林固定过程或其他预分析因素产生的伪影,而不是真正的HER2蛋白水平低于分析检测的下限。
Fernandez等人采用CAP能力验证数据中,约有20%的病例一致性较差(<70%)。述评专家认为这并不令人惊讶。能力验证的初衷只是为了鉴别阳性(IHC 3 )和非阳性(IHC 0~2 ),以确定能否接受曲妥珠单抗等传统抗HER2治疗。而IHC 0和1 之间的差异非常细微,对能力验证(区分阳或非阳)几乎没有影响。不过,他们也指出发送给1400个实验室的每个切片样本可能也存在细微差异。考虑到这些局限性,作者扩大了他们的调查范围,将170个组织切片发送给18名病理专家进行轮流阅片(round-robin exercise),结果显示这些病理专家在区分IHC 0和1 之间的差异方面,也和CAP能力验证场景一样,一致性水平不高。
临床实践中,IHC 0和1 都被视为HER2阴性,病理医生能否在较低水平的染色范围内重复、准确地区分表达水平,答案仍不得而知。述评专家认为,即便病理医生训练有素,能够重复、准确地区分二者,关于IHC的临床适用性仍存在以下几个关键问题。
1、是否能够设置可以区分IHC 0和IHC非0的参考标准?目前原位杂交技术(ISH)可以很好地区分IHC 2 的真阳性患者。预测标准(最好来自临床试验)是最理想的,但还没有任何不符合潜在生物表型的预测性生物标志物提供良好的依据。
2、IHC 0 vs 1 染色阈值对预分析因素的依赖性有多大,如缺血时间、固定剂中的时间,以及从组织块上切下未染色切片的时间?这是否会影响潜在预测性治疗阈值的有效性?
3、各实验之间的HER2 IHC抗体敏感性或其他分析因素的差异有多大?如果没有临床相关的金标准来衡量,这将是一个重大挑战。
4、组织异质性的影响有多大,以及应该使用多少样本来确定非零染色≥10%?当然,IHC 0和1 的异质性比IHC 3 更常见,临床上仅有不到5%的病例存在HER2过度表达/扩增的聚集异质性。
专家认为,如果IHC 0和IHC 1 或2 /ISH阴性的肿瘤之间确实存在有临床意义的生物学差异,则IHC作为表达谱低端肿瘤的检测可能不可靠。鉴于基因扩增、RNA转录和蛋白质表达之间的直接联系,mRNA或许可以作为重复性更好的一种定量分析。虽然最近有研究表明,在ER阳性乳腺癌中,HER2 IHC 0与IHC 1 /2 之间存在中值差异,但在数值范围上存在大量重叠。然而,在这项研究中,当观察ER阴性乳腺癌中HER2 mRNA表达水平时,这些差异几乎消失。
T-DXd等靶向于HER2的ADC似乎对不符合HER2扩增/过表达传统标准的乳腺癌具有抗肿瘤活性。现在需要确认的是其对没有HER2扩增/过表达的抗肿瘤活性,尚不清楚HER2阳性和非HER2阳性肿瘤的疗效有多大差异。专家认为HER2 ADC完全有可能将HER2受体作为释放其细胞毒性有效载荷的定位靶点,而不是直接的药效学靶点,就像在具有异常激活的ERBB2生长因子受体通路的肿瘤中一样。
最后,由于初步和正在进行的HER2 ADC随机临床试验中并没有纳入HER2 IHC 0的患者,关于IHC 0与1 阈值的相关问题尚没有答案。被称为“HER2低表达”(无论定义如何)的肿瘤似乎不是区别于“HER2 零表达”的特定生物学亚型,因为两者都包括管腔亚型和基底亚型,尽管可能存在预后上的细微差异,而且这种差异可能只与ER阳性肿瘤相关。
如果HER2 IHC 0和1 肿瘤没有生物学定义上的差异(临床有效性),那么治疗效果可能也没有差异(临床实用性),一些HER2 ADC最终可能会被证明对所有使用当前诊断标准归类为HER2阴性的患者提供有利的获益。事实上,法国一项探讨T-DXd治疗转移性乳腺癌的DAISY研究初步数据显示,即使在HER2 IHC 0疾病中也存在临床活性。


DAISY研究:T-DXd对HER2零表达患者有抗肿瘤活性
目前,尚不清楚在不符合HER2过度表达和扩增标准定义的肿瘤中,不同水平的HER2表达与临床获益之间是否存在相互作用。如果确实观察到相互作用,那么上述Fernandez等人的数据将提醒人们,当前的IHC可能不适合T-DXd的新用途。
▌参考文献:
[1]Fernandez AI, Liu M, Bellizzi A, et al. Examination of Low ERBB2 Protein Expression in Breast Cancer Tissue [published online ahead of print, 2022 Feb 3]. JAMA Oncol. 2022;10.1001/jamaoncol.2021.7239. doi:10.1001/jamaoncol.2021.7239
[2]Allison KH, Wolff AC. ERBB2-Low Breast Cancer-Is It a Fact or Fiction, and Do We Have the Right Assay? [published online ahead of print, 2022 Feb 3]. JAMA Oncol. 2022;10.1001/jamaoncol.2021.7082. doi:10.1001/jamaoncol.2021.7082
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






