共价键和离子键知识点(分子间作用力知识点)
29共价键 分子间作用力知识点
一 共价键和共价化合物
1.共价键
(1)形成过程
①氯分子的形成过程
eq \x(\a\al(两个氯原,子各提供,一个电子))―→eq \x(\a\al(两个氯原子,间形成共,用电子对))―→eq \x(\a\al(两个氯原,子达到8e-,稳定结构))―→eq \x(\a\al(形成稳,定的氯,气分子))
请你根据上述图示,用电子式表示其形成过程

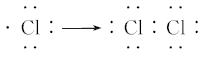
②下图形象地表示了氯化氢分子的形成过程

请你用电子式表示HCl的形成过程:


。
(2)概念:原子间通过共用电子对所形成的强烈的相互作用称为共价键。
(3)成键微粒:原子。
(4)实质:共价键的实质是共用电子对与成键原子之间的静电作用。
(5)形成条件:同种非金属原子或不同种非金属原子之间。
2.共价化合物
(1)概念:直接相邻的不同原子之间以共用电子对形成的化合物。
(2)常见的共价化合物:非金属氢化物:H2S、NH3、SiH4;酸:HCl、H2SO4、HClO等;弱碱:NH3·H2O等;非金属氧化物:CO2、H2O、NO等;有机物:CH4、C2H5OH、CCl4等。
3.共价分子的表示方法
(1)电子式:如H2的电子式为H∶H。
(2)结构式:常用一根短线"-"表示一对共用电子对,这种表示共价键的式子称为结构式;
(3)球棍模型、比例模型:表示共价分子的空间结构。
填写下表:

4.碳原子的成键特征
(1)碳原子最外层有4个电子,一个碳原子可以和其他原子形成4个共价键。
(2)碳原子之间可以通过一对、两对或三对共用电子对相结合,分别构成碳碳单键C—C、碳碳双键C=C、碳碳叁键C≡C。
(3)碳原子之间可以通过共价键彼此结合形成碳链,也可以形成碳环。
二 分子间作用力
1.分子间作用力
(1)概念:分子间存在着将分子聚集在一起的作用力。
(2)特征
①分子间作用力比化学键弱(填"强"或"弱")得多。
②存在于分子之间,且分子充分接近时才有相互间的作用力。
③分子间作用力主要影响由分子构成物质的熔沸点、溶解度等物理性质,而化学键主要影响物质的化学性质。如水从液态转化为气态只需要克服分子间作用力,而水分解需要破坏化学键。
2.氢键
(1)像H2O、NH3、HF这样的分子之间存在着一种比分子间作用力稍强的相互作用,这种相互作用叫氢键。
(2)氢键不是化学键,通常把氢键看作是一种较强的分子间作用力。氢键比化学键弱(填"强"或"弱"),比分子间作用力强。
(3)分子间形成的氢键会使物质的熔点和沸点升高(填"升高"或"降低"),对物质的溶解度有(填"有"或"无")影响,如NH3极易溶于水,主要是氨分子与水分子之间易形成氢键。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






