酵母菌表达系统(酵母TORC1信号通路重要调控机制)
真核细胞中高度保守的TORC1蛋白激酶复合物通过感受和整合外界生长因子、能量状态和营养水平等,调控细胞生长发育和自噬等重要生命过程。该信号通路的功能失调会引起多种疾病,包括肥胖症、糖尿病和多种癌症等。氨基酸是TORC1信号通路的重要激活因子。在高等真核生物中,氨基酸通过激活Rag小G蛋白复合物,由Ragulator五元复合物和Rag小G蛋白共同介导 TORC1在溶酶体上的定位和激活过程。但是在酵母中TORC1信号通路的调控机制还不清晰。

2019年9月25日,Science Advances在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)丁建平研究组和瑞士Fribourg大学Claudio De Virgilio研究组的一项最新合作研究成果:“Structural insights into the EGO-TC-mediated membrane tethering of the TORC1-regulatory Rag GTPases”,该研究阐明了参与酵母TORC1信号通路调控的重要蛋白质复合物EGOC的组装机制,揭示了真核生物TORC1信号通路调控的保守性。
丁建平研究组长期从事TORC1信号通路调控的分子机制研究,前期测定了人源Ragulator五元复合物的晶体结构,阐明了Ragulator复合物的组装机制和招募Rag小G蛋白的作用机制(Nature Communications,2017)。同时,也对酵母TORC1信号通路展开了深入研究。通过与瑞士Fribourg大学Claudio De Virgilio研究组展开合作,首先完成了酵母TORC1信号通路中Ego1-Ego2-Ego3(EGO-TC)三元复合物的晶体结构测定和功能分析(Structure,2012 ;CellResearch,2015)。在此基础上,测定了EGO-TC与酵母Rag小G蛋白的同源蛋白Gtr1-Gtr2共同形成的五元复合物(EGOC)的晶体结构,发现在EGOC复合物中, Ego2和Ego3与人源Ragulator五元复合物中的Mp1、p14、C7orf59和HBXIP都具有相似的Roadblock结构域,而Gtr1和Gtr2具有N端的小G蛋白结构域和C端Roadblock结构域。通过结构分析和功能实验,发现EGO-TC作为骨架蛋白发挥功能,通过Ego1 的N端结构域和Ego3分别与Gtr2和Gtr1小G蛋白C端的Roadblock结构域结合,招募Gtr1-Gtr2在酵母囊泡上的定位。通过结构比较发现,人源Ragulator复合物和酵母EGO-TC虽然不具有序列相似性,并且亚基数量也不一致,但是与小G蛋白Rag/Gtr相互作用的方式非常相似,表明这两个复合物在TORC1信号通路中发挥相似的功能。这些研究结果进一步阐释了真核生物中氨基酸等营养物质对TORC1信号通路的调控机制和保守性。
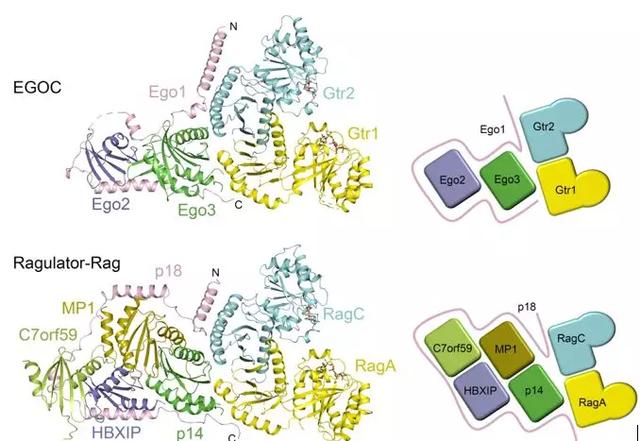
酵母EGOC与人源Ragulator-Rag复合物的结构比较
丁建平研究员和Claudio De Virgilio教授为本文的共同通讯作者,丁建平研究组的副研究员张天龙和Fribourg大学的Marie-Pierre Péli-Gulli博士为本文的共同第一作者。上海光源17U线站和国家蛋白质科学研究设施(上海)19U线站的工作人员在实验数据收集中提供了支持与帮助。
原文链接
https://advances.sciencemag.org/content/5/9/eaax8164
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






