高中化学高考方程式总结(高三化学总复习)
往期链接:点击直达
高三化学总复习——离子共存,你真的理解了吗?
高三化学总复习,化学除杂方法,你知道多少?
高三总复习之常见物理分离方法
化学总复习之阿伏伽德罗常数
一、要点1、电离方程式的书写
2、离子方程式的书写
3、离子方程式的判断
二、电离方程式的书写1、判断符号
①强电解质用等号,表示完全电离。
例:

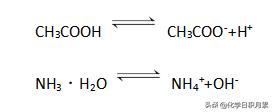
②弱电解质用可逆符号,表示部分电离。
例:
2、判断是否需分步
①多元弱酸需分步
例:

②弱酸的酸式盐需分步
例:

1、书写化学方程式(写)——难点!许多同学后期就是因为化学方程式不会写。
例:实验室制备CO2:
CaCO3 2HCl=CaCl2 CO2↑ H2O
2、将在水溶液中可溶且完全电离的化合物拆开(拆)——重点!
符合可拆要求的:强酸、强碱、可溶性盐,就这三类
例:
CaCO3 2H Cl-=Ca2 2Cl- CO2↑ H2O
3、将方程式两侧相同的离子删掉(删)
例:
CaCO3 2H 2Cl-=Ca2 2Cl- CO2↑ H2O
4、将删除后剩余的离子或物质进行整理,计量数化简(整)
例:
CaCO3 2H =Ca2 CO2↑ H2O
这就是实验室制备CO2的离子方程式。
总结:书写步骤:写、拆、删、整。
5、离子方程式的意义:
它表示同一类型的离子反应,即不同的化学方程式可能离子方程式相同。
例如:离子方程式:
CO32- 2H =CO2↑ H2O
可以表示可溶性碳酸盐和强酸在溶液中的反应。
四、离子方程式的正误判断1、查属实问题
即:本来不应该反应或者反应不应该生成此物质。
例:
①Fe和稀盐酸反应的离子方程式写成:
2Fe 6H = 2Fe3 3H2↑ 错误的!
Fe和稀盐酸反应生成Fe2 。
Fe 2H = Fe2 H2↑ 正确的!
2、查拆的问题
即:不该拆的物质给拆了,应该拆的没有拆!
注意:
1)微溶物,若为澄清溶液,可拆。若为悬浊液,不可拆
2)可溶性多元弱酸的酸式酸根一律写成酸式酸根离子的形式(如HCO3-)。
3)非水溶液状态下的反应,一般不用离子方程式表示。
如实验室中制备氨气的反应。
例:
①用碳酸氢钠治疗胃酸过多:C 2H CO2↑ H2O(×)
HCO3-不可拆
②向盐酸中滴加氨水:H OH- H2O (×)
NH3˙H2O不可拆
③石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓(×)
石灰乳为浊液,不可拆
3、查三守恒
即:电荷守恒、原子守恒、得失电子守恒
例:
①铜和氯化铁溶液:Fe3 Cu = Fe2 Cu2 (×)
等号左边3个正电荷,右边4个正电荷,违反电荷守恒
②铜和稀硝酸反应:3Cu 8H 2NO3- =3Cu2 2NO2↑ 4H2O (×)
等号左边6个氧原子,右边8个氧原子,违反原子守恒
③NaNO2溶液中加入酸性KMnO4溶液:
2MnO4- 4NO2- 6H+=2Mn2+ 4NO3- 3H2O (×)
2个高锰酸根总降10价,4个亚硝酸根总升8价,违反电子守恒
4、查符号问题
即:主要看等号和可逆符号使用是否合适
例:
①明矾溶液可用于净水:Al3 3H20Al(OH)3(胶体) 3H (×)
离子水解反应应该是部分水解,应该用可逆符号
5、查是否漏掉离子反应问题
即:误将某些物质拆开后删除,导致漏写。
例:
①Ba(OH)2溶液与硫酸反应: OH- H = H2O (×)
误将产物BaSO4拆开后删除,导致漏写。
6、查反应比例问题
即:将部分离子计量数约去,弄错反应物中离子比,导致错误。
例:
①稀硫酸与Ba(OH)2溶液反应:H OH- SO42- Ba2 = BaSO4↓ H2O (×)
溴化亚铁溶液中通入过量Cl2的离子方程式:
2Fe2 6Br- 4Cl2=2Fe3 8Cl- 3Br2 (×)
7、查少量过量问题
即:过量、少量、等物质的量、适量、任意量以及滴加顺序等对反应产物的影响
例:
①氢氧化钠溶液中加少量碳酸氢钙溶液:
Ca2 HCO3- OH- = CaCO3↓+H2O (×)
②用氢氧化钠溶液吸收足量的二氧化硫:
SO2 2OH-= S H2O (×)
8、注意某些氧化性物质
即:没有注意某些氧化性物质,按复分解反应处理,导致错误。
例:
①NaClO溶液中通入少量的SO2气体:2ClO- SO2 H2O = SO32- 2HClO (×)
HClO具有强氧化性,能够氧化SO32-
②Fe(OH)3溶于氢碘酸:Fe(OH)3 3H = Fe3 3H2O (×)
Fe3 具有强氧化性,能够氧化I-
9、注意反应体系的酸碱性
即:没有注意溶液酸碱性,酸性环境中,生成OH-或有OH-参加,导致错误。
例:
KClO碱性溶液与Fe(OH)3反应: 3ClO- 2Fe(OH)3=2Fe 3Cl- 4H H2O (×)
当前溶液为碱性,产物H 不能存在





往期链接:点击直达
高三化学总复习——离子共存,你真的理解了吗?
高三化学总复习,化学除杂方法,你知道多少?
高三总复习之常见物理分离方法
化学总复习之阿伏伽德罗常数
如果您喜欢,可以收藏、点赞加关注,您的支持,是我继续推出文档的动力!
网页版,排版不太好,想要文字word文档的,请留言私信我!
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






