高中化学naoh过量问题(高中有机反应消耗NaOH)

1、消耗NaOH最大最的计算
有机化学反应中,消耗NaOH的计算是热门问题之一,其规律为:酚羟基、羧基、酯基、卤素原子(连 在烃基上)、肽键、磺酸基在反应中均可消耗NaOH。
1 mol酚羟基、羧基、醇酯基(水解生成羧基)均可消耗 1 mol NaOH,1 mol酚酯基水解时(生成1 mol酚羟基和 1 mol羧基)消耗2 mol NaOH,1 mol苯环上的卤素原子在水解时(生成1 mol酚羟基和1 mol HX)消耗2 mol NaOH,1 mol烃基上的卤素原子在水解时(生成1 mol HX)消耗 1 mol NaOH。
例1已知卤代烃(R-X, R为烷基或苯基)在碱性 条件下能发生反应:R-X H2O → RoH HX。现有某有机物的结构简式如图所示:

1 mol该有机物与足量NaOH溶液共热,充分反应后,最多消耗NaOH的物质的量为()
A. 5 mol B. 6 mol C. 8 mol D. 4 mol
解析:与苯环直接相连的Cl、Br水解共消耗4 mol NaOH,连在苯环侧链上的Br水解消耗1mol NaOH,酚 酯基水解消耗2molNaOH,中和羧基消耗1 mol NaOH,总共消耗8 mol NaOH。故答案为选项C。
思路点拨:学习中应关注卤素原子在有机物结构中的位置,接连在苯环上卤素原子水解吋消耗NaOH 较多。
例2下列说法中正确的是()
A.普伐他汀是一种调节血脂的药物,其结构如图所4(未表示出其空间构型), 1 mol该物质最多可与1 mol NaOH反应

B. 1 mol的

最多能与含5 mol NaOH的水溶液完全反应
C.某有机物A是农药生产中的一种中间体,其结构简式为

1 mol A 可与 2 mol NaOH
D.1mol

跟足量的NaOH溶液反应,消耗NaOH物质的量最多为3n mol
解析:A项,有机物结构中含有醇酯基和羧基,1 mol该物质最多可与2 mol NaOH反应。
B项,1 mol的

中含有 酚羟基和3 mol 酯基(水解后生成1 mol羧基、1 mol酚 羟基、1 mol碳酸 ),所以最多能与5 mol NaOH的水溶 液完全反应,B选项正确。 本文来自化学自习室!
C项,1 mol该物质水解可生成1 mol 酚羟基、1 mol 羧基、1 molHCl 应消耗 3 mol NaOH 。
D项,1 mol 机物中含有3n mol酯基,水解后生成3n mol羧基和n mol酚羟基,消耗NaOH共为 4n mol。
思路点拨:做题时需关注立接连有羟基的六元环 是否为苯环,若不是,则该羟基不能消耗NaOH,如A 选项中的情况。
2 、 消耗H2最大量的计算
有机化学反应中,消耗H2的规律:1 mol -C=C- 加成时需1 mol H2, 1 mol -C
C-完令加成时需2 mol H2,1 mol 苯环加成时 3 mol H2,1 mol -CHO加成吋需1mol H2,,1 mol -CO-(酮中羰基)加成时需1 mol H2
例3下列叙述正确的是()
A.迷迭香酸其结构如图所示。1 mol迷迭香酸最多能和9 mol 氢气发生加成反应

B.β-紫罗乓酮是存在于玫瑰花、 番茹等中的一种天然香料,它经多步反应可合成维生素 1 mol中间体X最多能与2 molH2发生加成反应

C. 1 mol白藜芦醇

起反应的H2的最大用量是7mol。
D.霉酚酸酯(MMF,如图所示)是器官移植中抑制细胞增殖最常用的药物,1 mol MMF最多能与6 mol H2发生加成反应
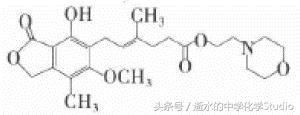
解析:A项中,1 mol迷迭香酸中含2 mol苯环和 1 mol碳碳不饱和键,最多能与7 mol H2发生加成反 应;B项中,1 mol中间体X含2 mol碳碳不饱和键和 1 mol -CHO,最多能与3 mol H2发生加成反应;C项中,1 mol内藜芦醇中含2 mol苯环和1mol碳碳不饱和键, 最多能与7 mol H2发生加成反应;D项中,1 mol MMF 中含1 mol 苯环和1 mol碳碳不饱和键,最多能与4 mol H2发生加成反应。故选C项。
思路点拨:羧基、酯基中的羰基(-CO-),不能与 H2发生加成反应;相同物质的量的碳碳双键与碳氧双 键消耗H2的能力相当。
3、消耗Br2最大量的计算
有机化学反应中,消耗溴的规律:1 mol -C=C-加 成时需1 mol Br2, 1 mol -C
C-完全加成时需2 mol Br2,酚羟基的两个邻位和一个对位的氢原子均可以被 溴原子取代,且每取代一个氢原子需要一个Br2,若有机物结构中酚羟基的邻、对位已经有取代基,则不能 再被溴原子取代;醛基与溴水发生氧化反应 1 mol -CHO 消耗 1 mol Br2
例4下列叙述正确的是()
A. 中药狼把草的成分之 一 M具有清炎杀菌作用,M的结构如图所示:

1 mol M最多能与3 mol Br2发生反应
B. 橙花醇具有玫瑰及苹果香气,可作为香料,其结构简式如图。1 mol橙花醇在室温下与溴的四氯化碳溶液反应, 最多消耗240 g溴

C.一种兴奋剂X的结构如图所示,1 mol X与足量浓溴水反应,最多消耗3 mol Br2
D. 1 mol白藜芦醇,

起反应的Br2的最大用量是7 mol
解析:A项,1 mol M中酚羟基的邻位发生取代反 应消耗2 molBr2,1 mol 碳碳双键发生加成反应消耗 1 mol Br2,故1 mol M最多能与3 mol Br2发生反应;B 项,1 mol橙花醇含有3 mol碳碳双键可与3 mol Br2发 生加成反应,最多消耗3 mol溴(480g溴),B错误;C 项,1 mol X中羟基的邻、对位发生取代反应需消耗 3 mol Br2, 1 mol碳破不饱和键与1 mol Br2发生加成 反应,共需4 mol Br2; D项,1 mol白藜芦醇中羟基的邻、对位发生取代反应需消耗5 mol Br2,1 mol碳碳不饱和键可与1 mol Br2发生加成反应,共需6 mol Br2。 故A项正确。
思路点拨:Br2参与的反应类型较多,在学习过程 中,需认真加以分析,尤其要注意每取代一个氢原子需要一个Br2。
4、消耗Na最大量的计算
有机化学反应中,消耗Na的规律:羟基(醇羟基、 酚羟基)、羧基能与钠反应,且消耗钠的物质的量分別与羟基、羧基的物质的量相同。
例5 某有机物的结构简式为:

则1 mol该有机物与足量的Na反应时,产生的H2在标 况下的体积为()
A. 22.4L B. 33.6L C. 11.2L D. 44.8L
解析:1个该有机物分子中含有1个醇羟基、1个 酚羟基、1个羧基,故1 mol该有机物可以消耗3 mol的 Na,生成1.5 mol H2,故H2在标况下的体积为33.6L 。B项正确。
思路点拨:理论上说酚类、羧酸都能与金属钠反应, 但会发生比水与金属钠更激烈的反应,因此在实际反应操作中应降低温度,每次反应时减小钠的颗粒(实际上一般不进行此类反应)。
5、消耗H2O最大量的计算
有机化学反应中,消耗H2O的规律:酯(包括油脂) 水解,分子中有几个-COO-在水解时就会消耗几个H2O;多肽(蛋白质)水解,分子中有几个肽键水解时会 消耗几个H2O。
例6某种解热镇痛药的结构简式如下,在酸性条 件下水解,1 mol该物质完全水解,消耗H2O的物质的量为()

A. 5 mol B. 4 mol C. 3 mol D. 2 mol
解析:1个该有机物分子中含两个-COO-、1 个-NH-CO-,故 1 mol 该有机物完全水解时消耗H2O 3 mol。故C项正确
思路点拨:有机物的水解反应,实际上是“失水”反应的逆反应,即反向补充水,“失水”反时去掉的基 团,水解时再恢复。
通过对有机化学反应中消耗NaOH、H2、Br2等特定物质的总结梳理,进一步明确抓“有关官能团”的性 质,是我们解决此类问题的关键。此外,还应关注官能 团的性质与所在的位置有关,同样是羟基,醇羟基与酚羟基有些件质就不同,如酚羟基有酸性而醇羟基无酸性。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






