表达mhc1类分子的无核细胞(利用Su1-Ph1抑制系统定向诱导部分同源染色体间的重组交换)
背景:小麦5B染色体长臂存在的Ph1系统 (Pairing Homoeologous),能够抑制部分同源染色体间的重组,使得从大部分近缘种属遗传物质向小麦中转移非常困难,是小麦遗传资源挖掘利用的瓶颈。打破Ph1系统的限制,诱导和提高小麦-外源部分同源染色体间重组,是有效利用近缘属种优良基因的关键技术难点。
2019年9月16日,《Theoretical and Applied Genetics》在线发表了来自加州大学戴维斯分校(UC Davis)、河南大学、以色列特拉维夫大学(Tel Aviv University)、爱荷华州立大学(Iowa State University)共同完成的题为"Recombination between homoeologous chromosomes induced in durum wheat by theAegilops speltoides Su1‐Ph1suppressor"的研究论文。本项研究中,研究人员证实在硬粒小麦中,Su1-Ph1可以诱导和提高部分同源染色体间的重组,并且可以用于靶向的外源染色体和小麦染色体间的重组,对于挖掘小麦近缘种属的优良基因具有重要的理论和应用价值。李浩博士为该论文第一作者,河南大学作物逆境适应与改良国家重点实验室(筹)/植物逆境生物学教育部重点实验室为第一单位,加州大学戴维斯分校Jan Dvorak教授为该论文的通讯作者。

在小麦亲缘关系较近的二倍体物种中,只有Triticum urartu和Aegilops tauschii向小麦的渐渗相对比较容易。在大部分的小麦×Ae. speltoides杂交后代中,只有当Ph1被Ae. speltoides抑制表达的时候,部分同源染色体才能重组;而在一些Ph1不被抑制的后代中,部分同源染色体并不能发生重组。目前外源遗传物质转入小麦的常用方法是利用5B染色体的缺体和Ph1缺失系,但是前期需要大量的鉴定工作,因而利用Ae. speltoides中的Ph1抑制基因提供了一种可靠的替代方法。前期Jan Dvorak团队定位了Ae. speltoides中能够抑制Ph1的两个主效QTL(Su1-Ph1和Su2-Ph1);随后利用细胞学筛选和分子标记辅助选择将Su1-Ph1片段渐渗到了普通小麦CS和四倍体小麦LDN中,并且证实Su1-Ph1由3S染色体长臂上,易位到了3A染色体长臂上。
为了探究LDN背景中Su1-Ph1的作用模式,我们构建了来自Ae. searsii的5Sse染色体代换5B染色体的单体代换系(即DM 5Sse LDN5B),随后将其与LDN-Su1-Ph1(即带有Su1-Ph1的LDN材料)进行杂交。F1代中,在不带有Su1-Ph1时,5Sse几乎不与LDN 5B配对;在带有Su1-Ph1时,5Sse与LDN 5B的减数分裂配对比例达到58.3%。进一步利用90K芯片对衍生的28个BC1F1 和 84 F2进行基因型扫描,制作5Sse与5B染色体65.31和63.71 cM的遗传图谱(图1)。BC1检测的12个重组事件全都发生在长臂;在F2检测到的28个重组事件中,只有3个发生在短臂,其余均发生在长臂。
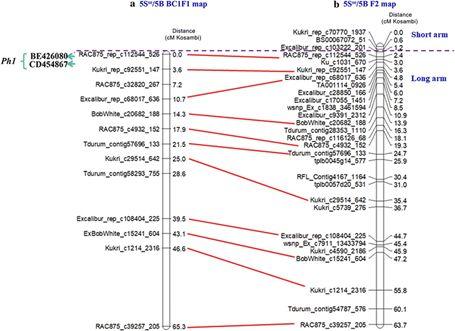
图1. 5Sse与LDN 5B部分同源染色体BC1和F2遗传图谱
对BC1图谱(代表雌配子发生)和F2图谱(代表雌配子和雄配子发生)分别计算重组率(cM/Mb),发现两者的重组类型比较相似,表明雌雄配子间的重组类型没有很大差异。随后将5B和5Sse作为部分同源染色体的代表,硬粒小麦5B和野生二粒小麦5B作为同源染色体的代表进行对比,发现5B同源染色体的平均重组率为0.19 cM/Mb,显著高于部分同源染色体间的0.09 cM/Mb(p = 0.005, two tailed t test)。比较5BL上proximal region (200 to 550 Mb)和distal region (550 to 725 Mb) 重组率的回归线斜率差异,两类染色体间的趋势存在部分差异(图2)。

图2. 部分同源染色体、同源染色体间重组率的比较差异分析
为了分析5Sse染色体的稳定性,首先对Ae. searsiiTE10核型分析,发现其5Sse和6Sse染色体带有随体染色体;随后对中国春的二体代换系DS 5Sse(CS5B)鉴定发现,代换系5Sse可能与其他部分同源染色体发生过重组。ND-FISH验证了部分后代5Sse和5B染色体间重组事件的发生,对29个5B长臂的skeleton marker与ND-FISH信号整合分析,构建了由5个bin组成的一致图谱(图3)。我们将Ph1位点定位于RAC875_rep_c112544_526(304,613,073bp),Kukri_rep_c92551_
147 (476,801,526 bp)之间约172Mb区域,位于bin 2区段,包含了ph1b缺失的60 Mb左右区域。其中3个Oligo-(GAA)10探针信号与该区域的C-bands信号相一致,即Ph1 位于长臂ND-FISH信号1 和2之间。Ph1位点位于5B染色体上的低重组率发生区,在172Mb区域内,共检测到3个重组事件,1个在BC1群体,2个在F2群体 (图1, Online Resource 1),覆盖到了Ph1的两个候选基因Zip4-B2和C-Ph1,其物理距离在1.2Mb左右,为了能够解决两者谁是Ph1真正候选基因的争议,通过构建当前群体30倍大小的3000个F2群体很可能解决这个问题,需要的工作量也比较巨大。

图3. 5Sse、5B染色体遗传图谱与ND-FISH信号整合分析
综上,我们证实在硬粒小麦中,Su1-Ph1可以用于诱导和提高部分同源染色体间的重组,以及靶向的外源染色体和小麦染色体间的重组,在Triticum–Aegilops种属内外的种质挖掘具有重要价值。由于Su1-Ph1对于Ph1具有显性效应,因而与传统的利用Ph1缺失系或者突变体(隐性效应)相比,Su1-Ph1更具有应用价值。此外,以Ph1为例,我们证实Su1-Ph1也可以用于低重组率染色体片段的渐渗和遗传定位。
第一作者简介:李浩,2016年西北农林科技大学-美国加州大学戴维斯分校联合培养博士,导师:吉万全教授,Jan Dvorak教授;2016-2018年美国加州大学戴维斯分校博士后,导师:Jan Dvorak教授;2018年入职河南大学加入宋纯鹏教授课题组,目前主要从事 “麦类作物抗逆种质资源挖掘、异源多倍体化和部分同源染色体重组交换的调控机制”等方面研究。
参考文章
1. Dvorak J, Deal KR, Luo MC (2006b) Discovery and mapping of the wheat Ph1suppressors. Genetics 174:17–27
2. Li H, Deal K, Luo M-C, Ji W, Distelfeld A, Dvorak J (2017) Introgression of the Aegilops speltoides Su1-Ph1 suppressor into wheat. Frontiers in plant science 8:2163
3. Li H, Wang L, Luo M-C, Nie F, Zhou Y, McGuire PE, Distelfeld A, Dai X, Song C, Dvorak JJT, Genetics A (2019) Recombination between homoeologous chromosomes induced in durum wheat by the Aegilops speltoides Su1-Ph1suppressor. Theoretical and Applied Genetics.https://doi.org/10.1007/s00122-019-03423-z

免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






