草酸钙结石跟肾囊肿有关系吗(草酸钙肾结石形成中的巨噬细胞功能)
Taguchi K, Okada A, Unno R, Hamamoto S, Yasui T. Macrophage Function in Calcium Oxalate Kidney Stone Formation: A Systematic Review of Literature. Front Immunol. 2021 May 24;12:673690. doi: 10.3389/fimmu.2021.673690. PMID: 34108970; PMCID: PMC8182056.

背景肾结石的全球患病率和复发率非常高。最近对兰德尔斑块和尿液成分在体内和体外(包括基因操作)的研究试图揭示肾结石的发病机制。然而,证据仍然不足以促进新型治愈疗法的发展。肾脏和外周巨噬细胞参与炎症过程提供了可能导致治疗靶点发展的希望。本系统文献综述旨在确定目前关于巨噬细胞在肾晶体发育和抑制中的作用的共识,并综合证据为未来的免疫治疗提供依据。方法我们在2021年2月根据系统评价和荟萃分析的首选报告项目(PRISMA)指南系统地审查了文献。从PubMed,MEDLINE,Embase和Scopus中提取了研究巨噬细胞与尿石症之间关系的文章,特别是草酸钙(CaOx)结石。研究对象、语言和出版日期不受限制。两位作者检索并筛选了这些出版物。结果虽然有几项研究已经应用了混合模式,但我们选择了380篇文章中的10篇,12篇和7篇(总共,n = 29篇),分别描述了培养的细胞,动物模型和人类样本。自1999年发现巨噬细胞参与肾结石以来,研究趋势已转向巨噬细胞表型和信号通路,包括微(m)-RNA。早期研究小鼠相关巨噬细胞加速和抑制肾晶体形成。后来的研究发现,促炎性M1-和抗炎性M2-巨噬细胞参与其中。体外和离体对人源性巨噬细胞和其他巨噬细胞的研究表明,M2巨噬细胞(受CSF-1,IL-4和IL-13刺激)可以吞噬CaOx晶体,从而抑制结石的发育。促进M2样巨噬细胞极化向卡奥克斯肾钙质沉着症的信号机制包括NLRP3、PPARγ-miR-23-Irf1/Pknox1、miR-93-TLR4/IRF1和miR-185-5p/CSF1通路。蛋白质组学研究结果表明,形成肾结石的患者主要表达M1样巨噬细胞相关蛋白,这可能是由于CaOx刺激巨噬细胞外泌体途径。结论本系统评价提供了有关巨噬细胞受累治疗CaOx肾结石的最新情况。靶向M2样巨噬细胞功能可能提供一种治疗策略,通过晶体吞噬作用来预防结石。
肾结石的患病率在世界范围内有所增加,其高复发率也是影响医疗和经济资源的一个因素(1-4)。大量的研究工作已经指向寻找治疗方法,但肾结石形成的病理学是复杂的,尽管有最近的技术创新,仍有待阐明。肾结石被认为是类似于代谢综合征(MetS)(5,6)的多因素疾病。肾功能,矿物质和脂质代谢,炎症过程,氧化应激和胰岛素抵抗可导致草酸钙(CaOx)晶体的形成(7).。
大多数肾结石由草酸钙(CaOx)组成(8,9)。为解释CaOx结石的发病机制而提出的假设是自由颗粒和固定颗粒机制(10);后者也被称为兰德尔斑块(RP),其由磷酸钙形成的磷灰石组成,磷灰石生长在Henle环周围的间隙空间中(11)。与在管状管腔或肾脏收集系统内发展的结石相反,RP的晶体前体被其他分子和细胞结构包围,这可能受到体内平衡受损的影响(12,13)。在这种岩石发生环境中,化学和矿物成分超载或其他炎症刺激源可能首先触发,然后是活性氧(ROS),随后诱导肾上皮细胞损伤,导致CaOx晶体沉积(14)。针对这种细胞损伤的主要防御机制是涉及内吞作用的自噬(15),次要防御机制延伸到间质空间的管周细胞和来自循环的免疫细胞(16)。清除肾组织中晶体沉积物的先天防御系统是为开发肾结石新疗法找到基本解决方案的关键。
了解巨噬细胞(Mφ)在肾脏晶体形成中的作用有助于鉴定溶液。肾结石病的肾脏或外周Mφ受累由de Water等人于1999年首次报道(17)。他们发现Mφs迁移到晶体沉积位点并吞噬晶体。鉴于M1促炎和M2抗炎(18)极化,Mφ参与肾脏晶体形成可能以不同的方式多样化。由于M2-吞噬晶体的能力大于M1样Mφs(19),因此调节其极化可能具有治疗价值(20)。在过去的二十年中,已经报道了许多关于Mφ预防肾结石发展的临床应用(21).
本系统综述旨在为Mφ在肾晶体发育和抑制中的功能提供集体证据,并为Mφ免疫治疗临床应用的未来Mφ研究方向提供思路。
转到(G):
材料和方法
本系统文献综述是根据系统评价和荟萃分析首选报告项目(PRISMA)指南(22)进行的。
检索策略
我们使用MeSH关键术语“巨噬细胞”或“巨噬细胞”,“单核细胞”和“尿石症”,“草酸钙”或“肾结石”检索了PubMed,MEDLINE,Embase和Scopus数据库。文章类型、出版日期、语言或物种在初始搜索期间不受限制。
资格
纳入了关注Mφ与单核细胞功能的关系以及尿石症发病机制的文章。描述Mφs和单核细胞分泌的炎性细胞因子/趋化因子发现的文章被排除在外,因为与Mφs和/或单核细胞的直接联系有限。由于我们专注于实验和转化发现,因此原始文章比评论或评论文章更受青睐,后者引用和/或总结了其他人发表的发现。
数据收集和描述
两位作者(KT和RU)独立审查了2月8日初步检索中发现的文章的标题和摘要千, 2021.数据是从符合资格标准的文章中提取的,并分别在初级和二级筛选期间在全文文章中重新评估。包括最近发表的重复文章。两个屏幕之间的分歧和差异通过与其他作者的讨论和共识得到解决。从所有符合条件的全文文章中提取以下数据:第一作者,期刊名称,出版年份,研究类型,方法,实验来源类型以及有关Mφ/单核细胞功能的主要发现。
Mφ表型的报告符合最新的命名法,实验指南(18)和有关器官特异性发现的综述(20,23,24)。
转到(G):
结果
在初始文献检索中,我们在所有数据库中确定了380篇符合检索策略和标准的文章。在第一页标题和摘要之后,第二页全文将它们过滤成29篇有资格审查的文章。图 1显示了棱镜流程图。表 1总结了1999年至2020年间在中国,德国,日本,荷兰,泰国和美国发表的29篇文章的结果。这些文章主要描述了转化性研究,包括体内高草酸尿症引起的肾钙质沉着症的大鼠和小鼠模型,小鼠,犬和人肾小管上皮细胞系体外,以及人肾乳头,外周血和尿液样本。细胞系和动物:3T3 / L1,小鼠脂肪细胞;Cdh16-ARKO,肾小管特异性雄激素受体敲除;HEK-293,人胚胎肾细胞;HK-2, 人近端小管上皮细胞;I9.1,小鼠巨噬细胞;J774.1,小鼠巨噬细胞;朱卡特,人T淋巴细胞;M-1,小鼠收集管;马迪克,犬肾小管上皮细胞;RAW264.7,小鼠巨噬细胞;SD大鼠,斯普拉格道利鼠;THP-1, 人单核细胞;U937,人类单核细胞。
AC,氯化铵;抗逆转录病毒,雄激素受体;砷1, 精氨酸酶1;ASC,细胞凋亡相关斑点样蛋白;BMDM,骨髓来源的巨噬细胞;氯化碳,C-C基序趋化因子配体;丙酮, C-C趋化因子受体;Chi3l3,几丁质酶3-样3;COM,草酸钙一水合物;脑脊液-1,菌落刺激因子-1;EG,乙二醇;狐狸1,叉头盒O1;转基因脑脊液,颗粒状巨噬细胞集落刺激因子-1;高频病,高脂肪饮食;羟基脯氨酸;高铁,热休克蛋白;腹内注射;干扰素;Irf,干扰素调节因子;Mφ,巨噬细胞;MAPK,丝裂原活化蛋白激酶;MCP-1,单核细胞趋化蛋白-1;大都会,代谢综合征;MIP1β, 巨噬细胞炎症蛋白-1β;不适用,不适用;Nos1,一氧化氮合酶1;Nfkb,活化B细胞的核因子kappa-轻链增强子;NLRP3,核苷酸结合寡聚结构域,富含亮氨酸的重复序列和含有3;OPN,骨桥蛋白的皮林结构域;PET-CT,正电子发射断层扫描 - 计算机断层扫描;PPARγ,过氧化物酶体增殖物活化受体 - γ;雷特纳,抗性蛋白样分子α;活性氧;RP,兰德尔的牌匾;RTEC,肾小管上皮细胞;SIRT3, Sirtuin 3;肿瘤坏死因子α;
体外和离体人单核细胞对肾结石成型剂中草酸钙晶体的作用
通布克等人是第一个报告人单核细胞与CaOx一水合物(COM)晶体之间蛋白质组学相互作用的人。研究人员发现,COM可以驱动氧化应激,导致细胞凋亡和禁止素,纤溶酶原激活物抑制剂-2,Alix,层粘连蛋白A / C和moesin的表达增加,以及细胞存活,蛋白质合成和稳定性,mRNA稳定性和脂质代谢降低。此外,La蛋白、异质核糖核蛋白H1、伸长因子-2、耳红蛋白-1、热休克蛋白(HSP)105和酰辅酶A硫酯水解酶水平降低(25)。还研究了与COM在肾小管上皮细胞(RETEC)中诱发的单核细胞功能相关的蛋白质组学。研究人员在与COM晶体孵育的马尔丁 - 达比犬肾(MDCK)细胞中发现了六种分泌的蛋白质,其表达水平显着改变。此外,他们报告说,ENOLASE-1(一种COM晶体结合蛋白)通过与单核细胞表面结合来激活单核细胞迁移(26)。
Williams等人进一步研究了人血清标本中的单核细胞线粒体功能,并报告与健康对照组相比,CaOx结石患者的单核细胞线粒体最大呼吸,储备能力和生物能量健康指数显着降低(27)。
体外M (–) (非极化巨噬细胞) 吞噬作用和草酸钙晶体反应
共聚焦激光扫描显微镜显示,与巨噬细胞集落刺激因子(M-CSF)共孵育的I9.1 Mφs(来源于小鼠脾脏细胞)溶解内化的CaOx晶体(28)。冈田等人利用莱索跟踪器、透射电子显微镜(TEM)和共聚焦光学显微镜进一步研究了Mφs对晶体的溶解,以研究小鼠J774.1 Mφ细胞系。作者证实了被吞没的COM晶体在Mφs(图 2).内化的COM晶体被吞噬体包围,吞噬体与溶酶体融合以促进溶解和自发消除(29)。Mφ 函数在 RTEC 中也进行了研究。M-1(小鼠收集管)和与小鼠Mφs孵育的RAW264.7细胞发展成促炎状态,增加COM晶体粘附,特别是当这些细胞与脂肪细胞共培养时。这种旁分泌机制与OPN,MCP-1和肿瘤坏死因子(TNF)-α的mRNA和蛋白质水平升高有关(30)。
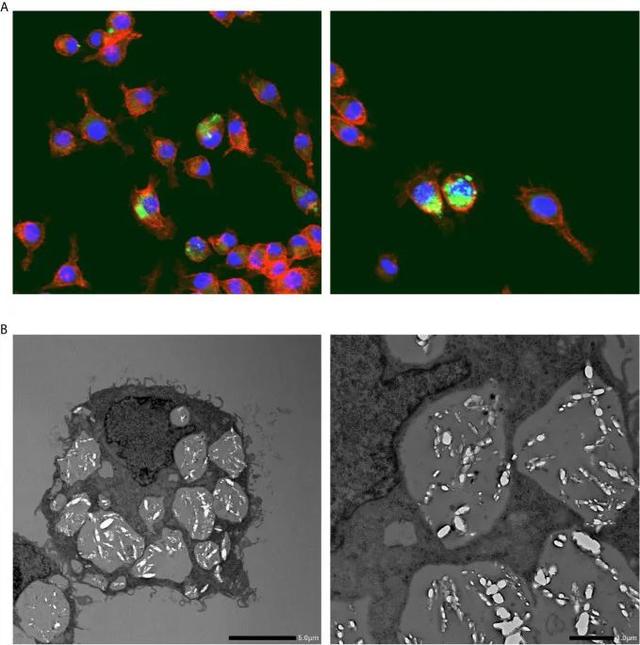
图 2
草酸钙晶体被巨噬细胞吞噬。(A)代表性照片显示了用草酸钙一水合物晶体培养的巨噬细胞(RAW264.8)的荧光免疫组织化学染色。红臼素;绿色:草酸钙一水合物晶体;蓝色,细胞核。放大倍数:×400。(B)吞噬草酸钙一水合物晶体的巨噬细胞(RAW264.8)的透射电子显微镜图像。比例尺,左侧和右侧面板,分别为 5 和 10 μm。
先前对来自与COM晶体一起孵育的人类单核细胞的Mφs的研究确定了吞噬COM晶体的吞噬体膜上的HSP90和F-肌动蛋白之间的关联。siRNA阻断HSP90降低了吞噬活性和Mφ迁移,表明HSP90和F-肌动蛋白在CaOx相互作用期间参与Mφ功能(31).由Mφs分泌的外泌体也受到COM晶体的影响。特别是,COM处理的Mφ外泌体具有增加的膜脆性,并且能够进入肾间质并触发RTEC释放IL-8,从而加重组织炎症(32)。因此,COM处理的Mφ外泌体增强单核细胞和T细胞迁移,单核细胞活化和Mφ吞噬作用。然而,用siRNA抑制维生素素可以消除这些作用,表明Mφ外泌体维生素素在对COM晶体的免疫反应中起重要作用(33)。
体内巨噬细胞参与草酸钙钙化钙质沉着症
虽然由于人肾结石形成和啮齿动物肾钙质沉着之间的差异,使研究结果适应人类患者存在局限性,但高草酸尿症大鼠和小鼠的CaOx肾钙质沉着模型被广泛用于研究,基于管内晶体形成和保留的相似性(34)。1999年描述了高草酸大鼠模型和草酸中毒患者在两个肾脏中包覆间质CaOx晶体的Mφs和多核巨细胞(17)。作者进一步证实,在大鼠高草酸尿症期间,外胚层发育不良1(ED1)阳性Mφs主要在肾晶体沉积部位周围增加,并且主要组织相容性复合物(MHC)II类阳性和其他单核细胞(35)。这些早期研究表明,Mφ溶解CaOx晶体,这可能与肾脏防御结石发育有关。冈田等人发现在乙醛酸盐诱导的肾钙质沉着症小鼠模型中自发消除的肾CaOx晶体沉积(36),并且随后的转录组研究将单核细胞/巨噬细胞的活化与这种现象相关联,涉及趋化因子(C-C基序)配体6,维门汀,Cd14,细胞色素P450家族1亚家族b多肽1,莫伊蛋白,载脂蛋白E,组织相容性2 II类抗原A α, 组织相容性2 II类抗原A β 1,以及脂多糖(LPS)诱导的肿瘤坏死因子。免疫组化发现也证实,F4/80阳性Mφs可以可视化为晶体沉积峰(37)。单核细胞化学吸引蛋白(MCP)-1、骨桥蛋白(OPN)、纤连蛋白、分化簇(CD)44和主要组织相容性复合物(MHC)II类的表达与肾脏晶体沉积量和F4/80阳性Mφs的表达有关。
体外和离体极化巨噬细胞对草酸钙晶体的功能
使用小鼠骨髓衍生的Mφs对M1和M2Mφs在CaOx晶体中的作用的检查表明,M(IL-4)具有比M(LPS)更大的吞噬COM晶体的能力(39)。此外,M(IL-4 IL-13)抑制COM晶体粘附在M-1小鼠收集管细胞上,并且具有比M(LPS IFNγ)更高的COM吞噬细胞速率(19)。
Yu等人使用人RTEC,HK-2细胞,M(LPS)从人单核细胞系U937分化,在体外检查Mφ在RP形成中的作用。他们发现,与羟基磷灰石一起孵育的共培养的M(LPS)和HK-2细胞会增加氧化应激,MCP-1和OPN表达,并降低胎儿蛋白-A(40)。同一组评估了M2Mφ在HK-2细胞中CaOx晶体诱导的氧化应激损伤和细胞凋亡中的作用,发现M(IL-4 IL-13)与人单核细胞THP-1细胞系分化。与阿泊红素类似,M(IL-4 IL-13)降低NADPH氧化酶p47phox蛋白的表达,增加线粒体膜电位,并抑制切割的半胱天冬酶-3,细胞色素c和磷酸-p38 MAPK的蛋白表达,以及用CaOx晶体孵育的HK-2细胞中的ROS释放(41)。这些结果表明,M1和M2Mφs在CaOx结石发育过程中RTEC的氧化应激损伤和凋亡中的作用相反。
来自人外周血单核细胞的M(CSF-1)显示出比M(GM-CSF)更强的吞噬CaOx晶体和天然肾结石的能力。抑制剂测定表明,肾结石清除是通过包合蛋白依赖性吞噬作用和内吞作用介导的(42)。多明格斯-古铁雷斯等人报告说,CaOx(而不是钾或ZnOx)诱导了人单核细胞系和表达CD86和CD68的原代人单核细胞的M1样Mφ分化,并分泌细胞因子和趋化因子。此外,CaOx处理的单核细胞的上清液可以增强M2Mφ CaOx晶体吞噬作用(43)。
体内极化巨噬细胞在肾尾草癌晶体发育中的功能
一些研究评估了肾结石形成中的Mφ极化。根据伴有高草酸尿症的肾钙质沉着症小鼠模型,在M2样Mφs较少的CSF-1缺陷小鼠中发生更多的肾脏和尿液晶体沉积(鉴定为CD11bF4 / 80CD163CD206 你好细胞),比野生型小鼠(39)。相反,类似 M1 的 Mφs(标识为 CD11bF4/80CD11c)的浪涌 整型Ly6C你好细胞)已在MetS模型小鼠中鉴定出瘦素缺乏和CaOx晶体沉积在用乙二醇(EG)处理下的肾脏中,并用高脂肪饮食喂养(44)。对M1和M2Mφ在结石发育中的作用的进一步研究表明,在腹腔内乙醛酸盐给药的C57BL / 6J野生型小鼠中,M1-和M2样Mφs的诱导/输注分别加速和减弱了肾晶体发育(19)。Anders等人研究了核苷酸结合寡聚结构域,富含亮氨酸的重复和含有吡咯烷结构域3(NLRP3),这是晶体病中炎症的中心分子介质,在高草酸盐饮食的Nlrp3缺乏小鼠中CaOx肾钙质沉着症形成中的作用。他们发现NLRP3抑制诱导浸润的肾脏Mφ从M1样(CD45F4 / 80CD11bCX3CR1 CD206)到M2样(CD45F4 / 80CD11bCX3CR1CD206TGFβ)表型的转变和肾纤维化的衰减。因此,NLRP3似乎通过促进从抗炎性M1向促炎和促纤维化M2样Mφs的转变来促进肾钙质沉着症相关的纤维化肾病(45)。 - -
巨噬细胞在人体组织中的作用和极化
人肾脏的微阵列分析显示,与未形成结石的患者相比,CaOx结石患者的肾组织中M2样Mφ相关基因、过氧化物酶体增殖物激活受体γ(PPARγ)、CD163和CD206的表达减少,M1样Mφ相关基因(包括一氧化氮合酶2、CSF2、IL10和C-C趋化因子受体2型)的表达增加(19).因果网络分析的结果将RP组织中的差异表达基因与显着更高的免疫细胞活性相关联,包括Mφs和浆细胞,它们与IL11,PG-内过氧化物合酶1,谷胱甘肽过氧化物酶3和RP中的单核细胞至Mφ分化有关,而不是在正常组织中(46).还研究了结石形成青少年的尿 Mφ 相关细胞因子。在一项小样本研究中,尿 IL-13/肌酐和 Mφ 炎症蛋白-1β (MIP-1β)/肌酐水平可作为结石的有用生物标志物,其敏感性分别为 50% 和 58%,特异性分别为 93%(47)。在未形成结石的个体、首次形成 CaOx 结石的个体和形成复发性 CaOx 结石的个体之间的尿液多重比较中,发现 IL-1a、IL-1b、IL-4、IL-10 和 GM-CSF 是影响结石发育中 Mφ 和中性粒细胞功能的潜在生物标志物(48)。此外,与未形成结石的患者相比,CaOx结石患者血液样本中的M1样Mφ极化增加了促炎细胞因子,例如TNFα,IL-1β和IL-1,以及M1 / M2样单核细胞比率(49)。
治疗靶点改变巨噬细胞表型对抗肾结石疾病
Sirtuin 3(SIRT3)是线粒体基质中NAD依赖性脱乙酰酶,通过脱乙酰叉头盒O1(FOXO1)(49)促进M2样Mφs,抑制体内肾CaOx晶体沉积。肾结石的患病率受性激素的影响(47)。在体外抑制RTEC中的雄激素受体(AR)表达增加Mφ募集并引起M2极化移位,这增加了肾内CaOx晶体的吞噬作用(47)。在体内给予肾小管特异性AR敲除小鼠和羟基-L-脯氨酸处理大鼠的AR降解增强剂,发现AR信号通过miR-185-5p的上调抑制CSF-1表达,导致M2样Mφs降低和CaOx晶体发育加速(50)。吡格列酮,一种PPARγ激动剂,治疗肾结石的潜力已被认可(51,52)。吡格列酮增加M2样Mφ极化并减少肾CaOx晶体沉积和炎症损伤,并在体外在小鼠骨髓衍生的Mφ和体内CaOx肾钙质沉着症小鼠模型中。这些结果表明,PPARγ上调miR-23表达,随后衰减干扰素调节因子1(Irf1)和Pknox1的表达,使Mφ表型从M1转移到M2(53)。已经研究了核因子红细胞2相关因子2(Nrf2)对CaOx结石个体PPARγ和抗炎过程的影响。研究结果表明,Nrf2通过在体外抑制通状受体4(TLR4)和IRF来减弱M1样Mφ极化位移。此外,Nrf2的激活剂萝卜硫素通过Nrf2-miR-93-TLR4 / IRF1轴对CaOx晶体形成和肾损伤起保护作用,其促进M2样Mφ极化并抑制CaOx肾钙质沉着症小鼠模型中体内的RTEC炎症(54)。已经研究了芳烃受体(AhR)作为肾CaOx结石发展中M1和M2样Mφs之间表型平衡的调节剂的参与(55)。骨髓来源的Mφs和CaOx肾钙质沉着症小鼠模型的转录组学和蛋白质组学分析表明,刺激AhR-miR-142a-IRF1/缺氧诱导因子(HIF)-1α轴会降低M1样Mφ并促进M2样Mφs,从而抑制肾脏CaOx晶体沉积和结石相关的肾损伤(55)。
转到(G):
局限性
本系统评价有几个局限性。首先,我们发现的大多数文章都使用M1 / M2Mφ定义与肾脏病学和泌尿外科领域的先前文献一致;因此,在某些情况下,很难根据最新的命名法来总结它们。其次,由于管内晶体沉积和CaOx结石形成之间的病理差异,肾钙质沉降小鼠模型的研究结果可能不适用于肾结石患者。最后,只有少数研究评估了人体组织中CaOx结石/晶体与Mφs之间的直接关系;因此,需要额外的活组织检查。
结论
Mφs在CaOx肾结石发展中的作用已经在体外,体内和人体标本中进行了研究。体外和离体研究表明,单核细胞和M(-)(非极化Mφs)具有通过吞噬作用消除CaOx晶体的能力。用COM晶体治疗RTEC通过细胞因子,趋化因子和外泌体刺激Mφ迁移。体内研究表明,M1样Mφs促进肾CaOx晶体的发育,伴有肾脏炎症,纤维化和细胞损伤,而M2样Mφs抑制CaOx晶体的发育。M2样Mφs,如M(CSF-1),M(IL-4)和M(IL-4 IL-13),具有更大的吞噬CaOx晶体的能力,最终溶解晶体片段,自分泌和旁分泌机制以及RTEC增强Mφ吞噬作用(图 3).此外,虽然只有少数研究调查了人体组织中的Mφ极化,但在肾结石形成者的尿液,血清和肾组织中可能存在主要的M1样Mφ细胞因子/趋化因子表型。

图 3
从当前文献中合成的关于M1和M2巨噬细胞在CaOx结石发育中的作用的证据方案。M1或M2Mφs通常通过各种细胞因子/趋化因子通过CaOx晶体的直接和间接影响与单核细胞和M0(具有中性极化)Mφs区分开来。M0 Mφs 自分泌机理通过AhR-miR-142a-IRF1/HIF-1α、PPARγ-miR-23a-IRF1/PKNOX1、Nrf2-miR-93-IRF/TLR4 和 SIRT3-FOXO1 轴将表型向钙氧化物晶体发展方向移动。反映单核细胞/Mφs和肾小管上皮细胞通过烯醇化酶-1和维门汀分泌的外泌体的单核细胞,然后被激活并变成M1或M2Mφs。相反,肾小管上皮细胞通过NLRP3和AR-miR-185-5p-CSF-1受累也是调节Mφ极化的重要因素。M1Mφs通过促进促炎和氧化应激分子(如iNOS,IL-6,IL-10和TGF-β)促进CaOx结石的形成,而M2Mφs通过溶酶体和包合蛋白中介的吞噬作用减弱CaOx晶体的发育,并通过吞噬作用消除它们,并诱导抗炎分子,包括精氨酸酶-1,Ym-1和PPARγ。芳烃受体;抗逆转录病毒,雄激素受体;脑脊液-1,集落刺激因子-1;狐狸1,叉头盒O1;转基因脑脊液,粒细胞 - 巨噬细胞集落刺激因子;HIF-1α,缺氧诱导因子-1α;iNOS,诱导一氧化氮合酶;IRF1,干扰素调节因子1;低碳酸氢钠,脂多糖;Mφ,巨噬细胞;M-脑脊液,巨噬细胞集落刺激因子;NLRP3,核苷酸结合齐聚结构域,富含亮氨酸的重复序列和含有3的吡喃结构域;PPARγ,过氧化物酶体增殖物活化受体 - γ;西尔图3, 西尔图因3;TLR4,通状受体4。
研究重点已从识别Mφ表达转向分析Mφ功能并找到改变Mφ表型以产生新治疗靶点的触发因素。然而,关于尿沉渣中Mφs的证据很少,需要确定直接操作Mφ表型用于临床(56)。未来的研究应努力建立液体活检的尿液生物标志物(57),以及使用抗体,载体和纳米颗粒的Mφ特异性靶向治疗。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






