带羰基的碳负离子稳定性判断(镍催化季碳手性中心的不对称合成)
季碳中心广泛存在于多种天然产物及生物活性分子中,因此发展高效合成季碳中心的新反应就显得非常重要。由于季碳中心位阻极大,所以构筑季碳中心并不容易;当该季碳为手性中心时,高立体选择性地构建该季碳中心就更为困难;如果利用手性催化而非当量手性辅基来诱导季碳立体中心的生成,那么困难度再上一层楼。从逆合成角度来讲,利用简单易得的消旋三级碳亲电试剂和碳亲核试剂为原料,通过手性催化来构筑季碳中心是最简单直接的合成方案(图1a),目前仅有的几个例子都是通过碳-卤键的异裂实现的,通过自由基中间体来构筑季碳手性中心的例子却鲜有报道。和三级碳正离子相比,三级碳自由基有许多优点,比如它们可以在温和的条件下产生,同时可以避免许多副反应(如消除反应、重排反应等)。
鉴于羰基α位季碳立体中心存在于许多重要分子中且可以转化为其他官能团,因此有关羰基α位季碳中心的研究最多。然而,传统的方法往往利用羰基化合物为亲核试剂,相比之下,利用羰基化合物为亲电试剂的报道却寥寥无几。2010年,美国加州理工学院的Gregory C. Fu教授课题组报道了二级羰基α-溴化物为亲电试剂、烯基锆为亲核试剂来构筑手性叔碳中心的偶联反应(J. Am. Chem. Soc., 2010, 132, 5010–5011)。在此基础上,作者设想能否用烯基锆试剂亲核试剂与三级羰基α-溴化合物进行偶联,这样的话就能构建季碳立体中心。近日,他们在Nature Chemistry上报道了镍催化的消旋三级卤代物(亲电试剂)与烯基锆试剂(亲核试剂)的不对称合成,构建了一系列手性季碳中心(图1b)。需要指出的是,上海交通大学的张万斌教授课题组前不久也发展了一个类似的利用烯基硼酸酯为亲核试剂来构建手性季碳中心的偶联方法(CCS Chem, 2019, 1, 623–631)。

图1. 研究背景及该文工作。图片来源:Nat. Chem.
首先,作者选用了环状的三级溴代物为亲电试剂、烯基锆为亲核试剂进行反应(图2)。经过一系列条件优化,作者发现当利用NiCl2 glyme (0.5 mol%)为催化剂、(S)-L1 (0.6 mol%)为配体、1,4-dioxane为反应溶剂在室温条件下反应24 h,能以88%的收率、98%的e.e. 值生成目标产物1 (entry 1)。为了评估不同条件对该反应的影响,作者开展了一系列对照实验。在无镍催化剂参加的条件下,反应几乎不能发生(entry 2)。在无配体参与的条件下,偶联反应虽然能进行,但是产率大大降低(entry 3)。另外,不同的配体对该反应的影响极大:当把最优配体L1分别换为其它含氮配体L2、L3、L4时,反应产率都大大降低(entry 4-6)。在该反应的最优条件下,烯基锆试剂的用量为1.2当量,当把该用量减为1当量时,反应的产率稍稍降低,但是e.e. 值不变(entry 7)。当把反应时间由24 h降为12 h时,反应产率和e.e. 值几乎无变化(entry 8)。作为Fu课题组发展新反应的一个标准操作,当向反应中加入微量水和空气时,虽然反应的e.e. 值无变化,但是反应产率却有所降低(entry 9-10)。降低催化剂的用量会降低反应效率(entry 11-13)。当把溴亲电试剂换为氯亲电试剂时,反应几乎不能进行(entry 14)。

图2. 环状卤代物不对称偶联反应的条件优化。图片来源:Nat. Chem.
在确定了最优反应条件后,作者对该反应的底物范围进行了研究(图3)。对于烯基锆试剂而言,烯基另一侧可以为一级碳(1)、二级碳(2)、三级碳(3)、TMS(4)、双键取代基(5)、芳基取代基(6)以及杂环取代基(7、8)。除了碳取代基,其他杂原子取代基也能耐受该反应,例如氧原子(9-14)、氯原子(15)、溴原子(16)及硫原子(17)。对于环状三级溴代物而言,环外取代基可以为一级、二级碳取代基(18-23);对于环状酰胺而言,氮原子上的保护基除了PMP外,还可以为一般的碳保护基(24-26)。除了环状酰胺,环状内脂(27-29)、苯并五元碳环(31-33)、五元共轭烯酮(34-35)以及含氟的苯并六元碳环(36-37)都能高效地参与该反应。值得强调的是,绝大多数底物的e.e. 值都在95%以上,产率中等到优秀(44%-90%)。

图3. 环状卤代物底物范围。图片来源:Nat. Chem.
随后,作者探索了链状三级卤代物的反应情况(图4)。需要指出的是,对于链状三级卤代物,该反应似乎只能对含有两个吸电子基团的卤代物适用。由于两个吸电子基团的存在,α-三级溴代物往往活性极高而不便于控制,所以作者选择了α-三级氯代物作为模板底物。经过一系列条件优化,作者发现链状三级氯代物和烯基锆试剂在NiCl2glyme (2.0 mol%)为催化剂、(R, S)-L2 (2.4 mol%)为配体、ZnF2(0.2 equiv)为Lewis酸、DME为反应溶剂的条件下于0 ℃下反应24 h,能以92%的收率、94%的e.e. 值偶联生成目标产物38 (entry 1)。对照实验表明,在无镍催化剂参加的条件下,反应几乎不能发生(entry 2)。在无配体参与下,偶联反应仍能进行,产率为76%(entry 3)。在无ZnF2的条件下,反应的产率和e.e. 值均有所降低,分别为64%和90% (entry 4)。当把最优配体L2换为L1时,反应产率降为26%,立体选择性则直接翻转(entry 5)。这些结果充分说明了环状底物和链状底物的反应活性不同。当反应温度由0 ℃升高为室温时,反应产率和e.e. 值都相应降低(entry 6)。当溶剂由DME换为1,4-dioxane时,反应的产率和e.e. 值也都相应减少(entry 7)。类似的,当把最优配体换为L5和L6时,反应产率和e.e. 值都逊于最优条件(entry 8-9)。

图4. 链状卤代物偶联反应优化。图片来源:Nat. Chem.
在确定了最优反应条件后,作者对链状氯代物参与偶联反应的底物范围进行了研究(图5)。对于链状氯代物而言,该反应似乎仅能对同时含有酯基和氰基的三级氯代物使用。在固定三个取代基中的两个后(即酯基和氰基),第三个取代基可以为一级和二级碳取代基(38-45)。同时,该反应也能耐受多种官能团,例如氧原子(46)、TBS保护基(47)、缩酮(48)、酯基(49)、氰基(50)、氟原子(51)、氯原子(52)以及酰亚胺(53)。此外,底物中的酯基部分可以为甲基酯(54)、苄基酯(55)、叔丁基酯(56-57)和酚酯(58)。对于烯基锆试剂而言,该反应和环状溴代物的使用范围类似,常见的烯基锆都能被兼容(59-69)。同样需要强调的是,链状氯代物参与偶联反应的e.e. 值都在90%以上,产率中等到优秀(34%-93%)。
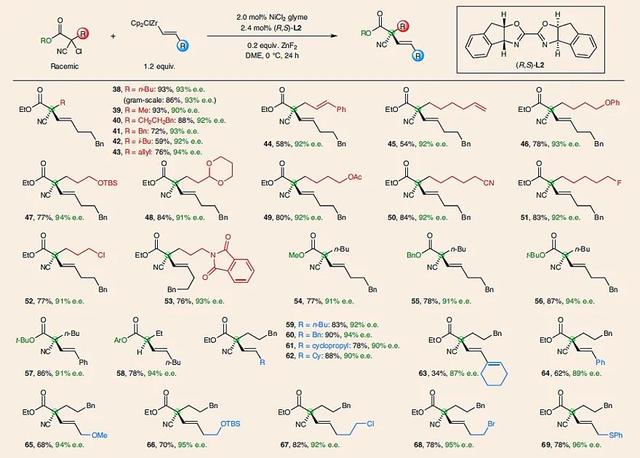
图5. 链状三级卤代物底物范围。图片来源:Nat. Chem.
为了研究该反应的机理,作者进行了如图6所示的对照实验。当选用含有一个双键的三级溴化物在标准条件下进行反应时,得到了一对消旋的非对映异构体(比例为1.2 : 1)。当使用该三级溴化物在自由基条件下与三丁基锡氢化物进行反应时,也得到了一对消旋的非对映异构体(比例为1.4 : 1)。相似的反应结果证明了该反应极有可能也经过了自由基中间体A及B。

图6. 反应机理研究。图片来源:Nat. Chem.
为了进一步研究该反应的合成应用价值,作者对反应产物进行了衍生化(图7)。在氧化条件下,6中的PMP可以被脱保护形成70(收率:80%);在氢气还原条件下,6中的烯基双键可以被还原得到71(收率:96%);在氢化铝锂还原条件下,6中的内酰胺基团可以被还原为胺72(收率:97%,图5a)。此外,链状产物38中的酯基可以在碱性条件下水解为羧酸73(收率:86%,图5b);在氢气还原条件下,38中的双键可以被还原为76(收率:90%);在LiBH4还原条件下,38中的酯基可以被选择性还原为醇74(收率:80%);通过控制还原条件,38中的氰基也可以被选择性性地还原为75(收率:72%)。随后,作者应用该偶联反应,通过简单的原料合成了中间体77和79(分别为天然产物(-)-Eburnamonine和Madindoline A的合成前体),进一步显示了该反应在天然产物合成中的应用价值(图5c和5d)。

图7. 产物的合成应用。图片来源:Nat. Chem.
总结
在这篇文章中,Gregory C. Fu教授课题组报道了一个镍催化的烯基锆试剂和三级卤代物的不对称合成反应,高效地构筑了羰基α位手性季碳中心。该反应条件温和,催化剂用量低,能兼容不同的羰基官能团,同时所有产物的e.e. 值都在90%以上。对于链状和环状底物,反应的最优条件稍有不同。机理研究表明该反应可能经过了一个自由基中间体。考虑到该方法的易操作性、原料的简单易得性以及羰基α位季碳中心的重要性,可以预见该方法将会在有机合成中得到广泛应用。
Quaternary stereocentres via catalytic enantioconvergent nucleophilic substitution reactions of tertiary alkyl halides
Zhaobin Wang, Ze-Peng Yang, Gregory C. Fu
Nat. Chem., 2021, DOI: 10.1038/s41557-020-00609-7
(本文由波纹供稿)
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






