血栓与止血学杂志的稿费(临床血管外科学)
第一章 周围血管胚胎发育和解剖学
第一节 周围血管的发育
受精卵(合子)——卵裂,形成桑葚胚——胚泡

胚泡由“胚泡腔、滋养层、内细胞团”组成。
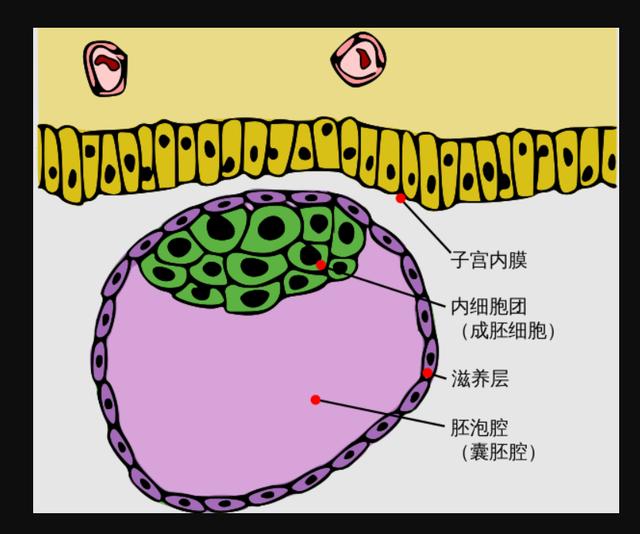
内细胞群内出现两个腔,背部的叫羊膜腔,腹部的叫卵黄囊。
羊膜腔的底,是外胚层。卵黄囊的顶,是内胚层。
内外胚层之间,隔着一层基膜,叫胚盘,是胚胎发育的原基。

胚胎发育第2周,胚盘尾端的中轴线上,部分外胚层细胞向腹侧增生——在内外胚层之间形成一条细胞索,称为原条——原条增生,形成胚内中胚层
滋养层细胞向胚泡腔内增生——填充胚泡腔——细胞腔隙——胚外体腔——胚外中胚层

人体内的一切组织和器官原基均来自外、中、内三个胚层,心血管系统就来自中胚层。
一、毛细血管的发生
人胚第3周,卵黄囊的胚外中胚层——分化成成血管细胞,称为血岛——血岛内中央细胞成为造血干细胞、周边细胞成为内皮祖细胞、相邻内皮细胞相连,形成原始毛细血管
同时,体蒂(连接羊膜腔和滋养层之间的胚外中胚层,将来形成脐带)和绒毛膜(滋养层演变而成)上的胚外中胚层也以相似的方式形成原始毛细血管,以出芽的方式扩展、连接,形成胚外毛细血管网。

成血管细胞表面有三种标志: CD34、AC133、VEGFR2
CD34是造血干细胞的重要标志,作为识别内皮祖细胞(EPCS)的标志之一;
VEGFR2特异性表达于淋巴管内皮。
成年人体内,生理性的血管生长仅限于女性生殖系统(排卵期的黄体、子宫内膜的血管增生)
病理性的生长,如创伤或修复,或依靠毛细血管的出芽,称angiogenesis;或建立侧支循环,称arteriogenesis。前者主要见于缺氧,后者主要见于较大动脉的堵塞。
(一)血管内皮祖细胞EPC
又称血管母细胞angioblast。
EPC的来源:人脐静脉血、成人外周血、骨髓,且外周血的EPC起源于骨髓,脐血的EPC来源于胎儿肝脏。
EPC的功能通过其动员和归巢来体现。
1.骨髓里干细胞的动员取决于局部微环境,称之为干细胞龛,由成纤维细胞、成骨细胞和内皮细胞组成。
2.正常情况EPC不到0.01%。局部血管损伤、缺血、烧伤和细胞因子均能刺激EPC从骨髓中动员出来,进入血液循环系统,迁移到循环系统的内皮损伤处。
3.EPCS的动员是一个复杂的过程。除外细胞因子,细胞外基质的重建是动员EPCS的关键步骤,其由基质金属蛋白酶(MMP9)介导。
(二)血管生长因子
Vascular endothelial growth factor,VEGF
有四种异构体,根据所含氨基酸数目,分为121、165、189、206。
VEGF165是体内存在的主要形式。
VEGF的受体有3种:-1(flt-1)、-2(KDR/FLK-1)、-3(flt-4),均属于络氨酸激酶受体,-2对血管内皮细胞的增殖、移动与通透性具有重要作用。
VEGF-1、-2主要表达于血管内皮细胞,-3主要表达于淋巴管内皮细胞。
(三)其他血管生成因子
1.血管生长素(ANG):促进新血管生成的诱导剂,与血管内皮细胞结合力高,与细胞外基质结合力低。
ANG主要由肝脏合成,作为一种应激时相蛋白,在急性炎症时诱导增生。
2.血管生成素(Angs):卵巢血管生成过程中,Angs与VEGF协同调节血管的生成或消退。目前有4种,与血管形成密切相关的是-1、-2,通过Tie 2络氨酸酶受体发挥作用。
Angs-1调节血管成熟过程,维持血管结构的完整性。
卵巢排卵期前,Angs-2增加血管细胞对VEGF的反应。VEGF促血管生成后,Angs-1维持血管结构的稳定和成熟。
3.成纤维细胞生长因子(FCG)
并非起关键作用
4.肥大细胞与血管新生
释放类胰蛋白酶,达到降解基质的目的;
分泌组胺,促进成纤维细胞生长、胶原合成和微血管内皮细胞增生。
5.血管生成抑制因子
(1)特异性的血管生成抑制物:血管抑素、内皮抑制素,是肿瘤细胞产生的。
(2)非特异性的血管生成抑制物:干扰素-γ(IFN-γ)、转移生长因子-β(TCF-β)、肿瘤坏死因子(TNF)、组织金属蛋白酶抑制剂(TIMPs)
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






