高中有关fecl的化学方程式(高中化学Fe3和Fe2的相互转化)
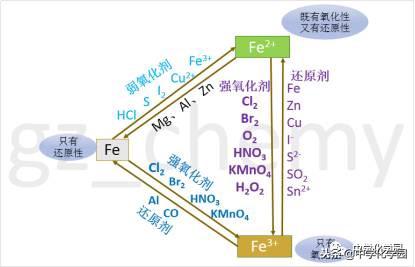
从Fe2 和Fe3 的结构可知:Fe3 通常只有氧化性,Fe2 既具有氧化性又具有还原性。上述微粒通过跟一定的氧化剂或还原剂发生氧化还原反应,才能实现不同价态的铁相互转化。当铁遇弱氧化剂(如S、H 、Cu2 、I2等)时,铁只能失去最外层的两个电子,而生成 2价铁的化合物;当遇到强氧化剂(如Cl2、Br2、HNO3等)时,铁原子可以再失去次外层上的一个电子而生成 3价铁的化合物。
(1) Fe→Fe2 需要较弱的氧化剂,如Cu2 (CuSO4)、H (稀H2SO4、盐酸) 、S等。
Fe 2H =Fe2 H2↑
Fe Cu2 =Fe2 Cu
Fe 2Fe3 =3Fe2
Fe S=(△)FeS
Fe I2= FeI2
(2) Fe2 →Fe在金属活动性顺序表中排在Fe前的金属,如Mg、Al、Zn等,可以将Fe2 还原成Fe。
Zn Fe2 =Fe Zn2
注意:K、Ca、Na等活泼金属,由于它们在水溶液中不能存在,所以不能作为还原剂来完成Fe2 →Fe的转化。
C 2FeO=(加热)2Fe CO2
CO FeO=(加热)Fe CO2
H2 FeO=(加热)Fe H2O
(3) Fe→Fe3 需要强的氧化剂。如O2、Cl2、Br2、HNO3(浓、稀)、H2SO4(浓)、KMnO4(H )溶液等。
2Fe 3Cl2=(点燃)2FeCl3
2Fe 3Br2=(点燃)2FeBr3
Fe 6HNO3(浓) =(△)Fe(NO3)3 3NO2↑ 3H2O
Fe 4HNO3(稀)=Fe(NO3)3 NO↑ 2H2O (如果铁过量,则生成Fe2 )
3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
2Fe 6H2SO4(浓)=(△)Fe2(SO4)3 6H2O 3SO2↑
注意:Al、Fe遇冷浓HNO3、浓硫酸钝化(常温)
(4)Fe3 →Fe常发生在金属的热还原反应中。如高温下用CO还原铁矿石中的铁。
3Zn 2Fe3 =3Zn2 2Fe
Fe2O3 2Al=(高温)2Fe Al2O3
Fe2O3 3CO=(高温)2Fe 3CO2
3C 2Fe2O3=4Fe 3CO2
3H2 Fe2O3=2Fe 3H2O
(5) Fe2 →Fe3 需要强的氧化剂。如O2、Cl2、Br2、HNO3(浓、稀)、H2SO4(浓)、KMnO4(H )溶液等。
Fe2 有还原性,高锰酸钾、重铬酸钾、过氧化氢等氧化剂能把它氧化成Fe3 :
①2Fe2 Cl2=2Fe3 2Cl-(在亚铁盐溶液中通入氯气,溶液由浅绿色变为棕黄色)。
②2Fe2 Br2= 2Fe3 2Br-
③在酸性溶液中,空气中的氧也能把Fe2 氧化:
4Fe2 O2 4H =4Fe3 2H2O
12FeSO4 3O2=4Fe2(SO4)3 2Fe2O3(亚铁盐溶液在空气中容易变质,绿矾露置于空气中)
④3Fe2 NO3- 4H =3Fe3 2H2O NO↑
⑤5Fe2 MnO4- 8H =5Fe3 4H2O Mn2
⑥2Fe2 H2O2 2H =2Fe3 2H2O
⑦Cr2O72- 6Fe2 14H =2Cr3 6Fe3 7H2O
(6)Fe3 →Fe2 需要较强的还原剂。如Fe、Zn、H2S(S2-)、KI(I-)、Na2SO3(SO32-)等,Cu虽不是强的还原剂,但因Fe3 具有较强的氧化性,可被Cu还原成Fe2 。
①Fe3 还能被金属铁还原:
2Fe3 Fe=3Fe2 ,在FeSO4溶液中往往要加铁的原因是可以防止Fe2 被氧化为Fe3 。
②在无线电工业上,常利用FeCl3溶液来刻蚀铜,制造印刷线路。
2Fe3 Cu=2Fe2 Cu2
③2Fe3 2I-=2Fe2 I2,Fe3 具有氧化性,它能把I-氧化成I2
④在FeCl3溶液中滴加适量的Na2S溶液,溶液变浑浊,滤去沉淀则滤液为浅绿色
2Fe3 S2-=2Fe2 S↓
如加入过量的Na2S溶液,则又有黑色沉淀生成(FeS);
向Fe3 溶液中通入H2S气体的离子方程式为:2Fe3 H2S=2Fe2 2H S↓。
⑤2Fe3 SO2 2H2O=2Fe2 SO42- 4H
⑥2Fe3 Sn2 =2Fe2 Sn4
编辑整理by中学化学园,转载请注明出处~
,
免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com