如何申请car-t细胞疗法临床试验(超级CAR-T细胞疗法)
Precigen是一家致力于开发创新基因和细胞疗法以改善患者生活的生物制药公司。近日,该公司宣布,美国食品药品管理局(FDA)已授予PRGN-3006孤儿药资格(ODD),这是一款首创疗法,采用Precigen公司非病毒UltraCAR-T治疗平台开发,用于治疗复发或难治性急性髓性白血病(AML)(临床试验标识符:NCT03927261)。在2019年第三季度,Precigen公司宣布已经完成了这项临床试验的第一个队列的患者入组,并预计在2020年下半年公布首批数据。
孤儿药(Orphan Drug)是指用于预防、治疗、诊断罕见病的药品,而罕见病是一类发病率极低的疾病的总称,又称“孤儿病”。在美国,罕见病是指患病人群少于20万的疾病类型,罕见病药物研发方面的激励措施包括各种临床开发激励措施,如临床试验费用相关的税收抵免、FDA用户费减免、临床试验设计中FDA的协助,以及药物上市后针对所批准适应症为期7年的市场独占期。
Precigen公司总裁兼首席执行官Helen Sabzevari博士表示:“FDA授予PRGN-3006孤儿药资格,强调了对治疗AML患者的新疗法的关键医学需求。AML是一种进行性、衰弱性和往往致命的疾病,治疗选择有限。作为我们专有UltraCAR-T治疗平台的第一个监管资格认定,此次孤儿药资格将有助于推进PRGN-3006的开发,并提供重要的激励和支持,以尽快为那些患有这种疾病的患者提供这种药物。”

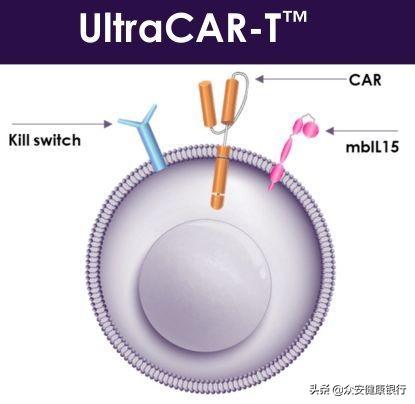
PRGN-3006利用Precigen公司变革性UltraCAR-T治疗平台开发,该平台消除了体外扩增、缩短了制造时间,并提供了在非病毒基因转移后仅一天在癌症中心对患者实施CAR-T治疗的能力。PRGN-3006 UltraCAR-T是一种多基因CAR-T细胞疗法,利用Precigen公司先进的非病毒基因传递系统共同表达一种嵌合抗原受体、膜结合白细胞介素-15(mbIL15)和一个杀伤开关,在靶向复发或难治性AML和高风险MDS方面具有更好的精确性和控制性。
评估PRGN-3006 UltraCAR-T在基因转移后一天非病毒、多基因自体CAR-T细胞给药治疗AML和MDS的临床前数据已在2019年美国血液学会(ASH)年会上公布。
Precigen公司的UltraCAR-T平台有潜力通过缩短生产时间、降低生产相关成本、使用先进的方法精确肿瘤靶向和免疫系统控制增加患者获取,从而颠覆当前CAR-T细胞治疗的格局。
该平台带来了几个关键的进步:1)非病毒基因转移利用多基因载体表达多效应基因,提高了肿瘤靶向的精确性和控制能力,消除了对病毒的需求;2)输注UltraCAR-T的持久性和期望表型,有助于解决T细胞衰竭,这是当前CAR-T疗法的一个常见问题;3)通过结合杀伤开关技术来控制T细胞,可潜在地提高安全性;4)使用专有的非病毒基因转移过程快速制造UltraCAR-T细胞,消除了体外增殖的需求,因此将患者在基因转移后的等待时间从数周缩短至一天。


原文出处:Precigen Receives FDA Orphan Drug Designation for PRGN-3006 UltraCAR-T™ in Patients with Acute Myeloid Leukemia (AML)
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






