分子植物育种现状与展望(5G育种技术之植物性状订制)
行业展望
我国农作物种业市场规模逐年增长,其中以粮食作物种子市场规模较大。目前我国育种产业发展仍处于初级阶段,存在龙头企业市场占有率和行业集中度不高、企业育种技术和水平落后于发达国家、种企研发投入不足等问题。虽然基因编辑技术的出现有望改变这种局面,但我国在基因编辑农作物研发方面处于国际领先水平,产业化却处于落后的局面。
2022年1月24日,我国农业农村部印发了《农业用基因编辑植物安全评价指南(试行)》,针对未引入外源基因的基因编辑植物制定了新的评价指南。该指南对我国国内的基因编辑植物和转基因植物进行了区分,这无疑将极大促进合成生物技术在农业领域更好地应用和发展,不涉外源基因的改造植物或将放宽。该指南的发布标志着我国基因编辑育种技术的产业化将逐渐步入正轨。
未来加大种业研发创新、加强生物育种技术应用和加快优质品种商业化推广进程将是大势所趋。在后期发展中,国家政策对育种产业的支持力度有望不断加大,同时以基因编辑为代表的技术应用将成为推动我国种业市场规模增长的主要动力。在传统育种方面,我们与发达国家的差距较大,但基于基因编辑的育种产业我们处于跟踪国际、寻机赶超的阶段,很有可能实现弯道超车。
性状订制举例
基因编辑育种技术的优势之一是它可以加速品种改良(图1),同时该技术可得到无任何外源基因序列整合但基因组却被编辑过的植株(图2),相当于自然条件下得到的突变体。

图1 基于生物技术发展的四种育种技术 (Gao et al., 2021)。基于自然发生的突变被用于将各种优良性状引入受体材料(8-10年)。突变育种(8-10年)用于在全基因组引入随机突变,极大地拓展了遗传变异。杂交和突变育种通常需要很长时间。转基因育种(8-12年)可以用来引入其他生物的基因或性状,但外源DNA会随机整合到植物基因组中,而转基因作物的商业化需要经过漫长的监管及评估过程。基因编辑技术可用于编辑植物的基因组,最终可得到无外源DNA的植株。基于基因编辑的育种技术(2-5年)被称为5G育种技术。
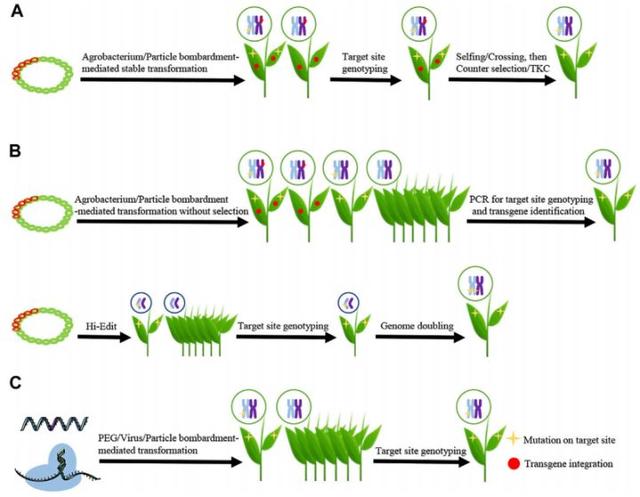
图2 分离无转基因成分(transgene-free)植株的策略 (Gu et al., 2021)。(A)通过遗传分离消除转基因序列,CRISPR/Cas DNA(红色双链)通过农杆菌或粒子轰击递送进入植物细胞。检测转基因阳性植株,再通过检测靶位点基因型筛选基因编辑植株,此后经过自交可分离出无转基因成分的基因编辑植株;(B)通过农杆菌或粒子轰击,将CRISPR/Cas DNA序列瞬时递送进入植物细胞,通过PCR从所有再生幼苗中分离出无转基因成分的基因编辑植株;若使用Hi-Edit策略,选择单倍体后代并检测靶位点基因型,再对单倍体编辑植株进行染色体加倍,得到无转基因成分的纯合基因编辑植株;(C)将CRISPR/Cas RNA或RNPs递送进入植物细胞,通过检测靶位点基因型分离出无转基因成分的基因编辑植株。
下面大家就和伯小远一起去看看有哪些基础研究将来可能会应用于育种中吧(图3)!

图3 基于CRISPR的基因编辑系统在植物育种中的应用 (Ahmad et al., 2021)。(a)诱导雄性不育系,通过编辑TMS5开发出的雄性不育系可为两系杂交水稻系统节省时间和成本;(b)固定杂交优势,在MiMe材料中编辑MTL基因可生产杂交水稻种子;(c)诱导单倍体,例如,在水稻中,编辑MTL、DMP或CENH3可生产单倍体诱导系;(d)开发适应气候变化的品种,编辑Su-/Se-基因可以生产可抵抗各种环境胁迫的品种;(e)从头驯化,同时编辑与不同性状有关的多个基因可以更快、更有效地驯化野生作物;(f)基因聚合,通过同源定向修复(HDR)在一条染色体上聚合多个有益的基因;(g)克服自交不亲和,通过敲除控制自交不亲和的S-RNase基因解决马铃薯自交不亲和的问题;(h)染色体易位,基于异源末端连接(NHEJ)的染色体工程可以帮助作物提高产量等;(i)促进种间交叉相容,通常种间是无法杂交的,但CRISPR编辑技术可用于打破这些障碍;(j)新物种形成,例如,MiMe材料会产生2n配子,自交(2n 2n=4n)或与野生型回交(2n 1n=3n)后,可以产生新物种,这对于无性繁殖的园艺作物非常重要。
基因编辑技术给了我们太多的想象(图3),对育种来说,我们的目的无非是让作物更高产、更营养、更抗病。因此,可以用来做性状订制的基因实在太多啦,小远就选一个育种家比较关心的抗除草剂性状,来分享一下这方面的知识吧。
目前世界粮食累计产量约为21亿公吨,粮食总产量损失约为2亿公吨,其中10%的损失是杂草造成的 (Hussain et al., 2021)。在现代农业系统中,使用除草剂是控制杂草的主要策略,但除草剂不仅会破坏杂草,也会影响农作物,所以育种家开始培育抗除草剂作物 (Shah et al., 1986)(图4),尽管转基因育种是成功的,但它存在监管问题,基于基因编辑技术开发抗除草剂品种是目前转基因抗除草剂育种和常规抗除草剂育种的替代选择。

图4 世界首例抗除草剂转基因植物于1986年报道。除草剂草甘膦是EPSP合酶的有效抑制剂,过表达EPSP合酶基因可实现EPSP合酶的高水平表达,使植物对草甘膦具有耐受性。图片来源:伯远生物科研绘图团队《她的百年沉浮,都与你的转基因植株有关》。
除草剂种类繁多,作用机制也各有不同,主要可分为两种类型:i,选择性/非选择性除草剂。选择性除草剂主要基于植物激素起作用,抑制目标杂草的生长,不会影响作物,例如2,4-D、麦草畏、甲氯丙酸。非选择性除草剂会影响所施用的所有植物,例如草甘膦、草铵膦、百草枯。ii,内吸/接触性除草剂。内吸性除草剂通过维管组织在整个植株中转移,比接触性除草剂需要更长的时间来杀死杂草。接触性除草剂仅破坏与这些除草剂接触的植物组织,并不会转移到整个植株中 (Hussain et al., 2021)。
这里给大家列举一些常见的除草剂:
草甘膦:草甘膦是内吸性非选择性除草剂,是烯醇丙酮酰莽草酸3-磷酸合酶(EPSPS)抑制剂,EPSPS在植物中用于合成芳香族氨基酸。
草铵膦:草铵膦是广谱接触性非选择性除草剂,作用相对较快,通过抑制谷氨酰胺合成酶导致植物光呼吸受到抑制,同时,它还可以诱导ROS的产生从而导致细胞快速死亡。
乙酰乳酸合酶(ALS)抑制剂类除草剂:ALS是三种支链氨基酸(亮氨酸、异亮氨酸和缬氨酸)合成的第一步关键酶,ALS抑制剂会使受影响的植物缺乏这些氨基酸,最终导致细胞DNA合成受到抑制。ALS抑制剂包括各种磺酰脲类(SU)(如氟嘧磺隆和甲磺隆)、咪唑啉酮类(IMI)、三唑并嘧啶类(TP)、嘧啶基苯甲酸酯(POB)和磺酰氨基羰基三唑啉酮(SCT)。ALS生物途径仅存在于植物中,因此ALS抑制剂是最安全的除草剂之一。
乙酰辅酶A羧化酶(ACCase)抑制剂类除草剂:ACCase参与脂肪酸合成的第一步,ACCase抑制剂影响植物脂肪酸合成从而导致植物死亡。ACCase抑制剂包括芳氧基苯氧基丙酸酯(APP)、环己二酮(CHD)和苯基吡唑啉(PPZ)。
羟苯基丙酮酸双加氧酶(HPPD)抑制剂类除草剂:HPPD抑制剂会抑制参与酪氨酸分解的酶,而植物需要利用酪氨酸分解产物制造类胡萝卜素来保护叶绿素不被阳光破坏,因此,施加HPPD抑制剂类除草剂会使植物丧失叶绿素,变白直至死亡。
基于基因编辑技术开发抗除草剂品种主要在于靶位点的突变。目前已在杂草中发现了8个变异的ALS基因,这些天然突变赋予了ALS对除草剂的耐受性,涉及到的氨基酸残基为Ala122、Pro197、Ala205、Asp376、Arg377、Trp574、Ser653和Gly654,其中氨基酸数是基于拟南芥ALS基因的。杂草获得ACCase抑制剂耐受性是由于以下7个位置的氨基酸突变;Ile1781、Trp1999、Trp2027、Ile2041、Asp2078、Cys2088和Gly2096。对于EPSPS基因来说,已知在Thr102、Ala103和Pro106处发生的突变使杂草进化出了草甘膦抗性 (Dong et al., 2021)。
下面列举了抗除草剂靶位点的突变使水稻、玉米、小麦、大豆等作物获得除草剂耐受性的报道(表1)。篇幅所限,没有详细介绍,如果大家感兴趣的话,可以给小远留言,今后再详细写一写啦!
表1 基于CRISPR基因编辑技术开发的抗除草剂植物 (Dong et al., 2021)。表中列举了靶基因、突变位点、抗性物种、基因组修复方式。

商业化案例
目前各国对基因编辑产品的态度不一,巴西、阿根廷、日本、美国等国家较为宽松,欧盟、墨西哥等态度谨慎,认为基因编辑作物与转基因作物实质等同。具体可参考下表中各国的农业基因编辑指数。
表2 农业基因编辑指数。下表的基因编辑指数评级代表了各国目前基因编辑法规的状态。数据来自于Global gene editing regulation tracker。

在这里先介绍一种被美国农业部(USDA)批准上市的基因编辑大豆,该大豆是通过TALEN介导的基因编辑技术生产的,是美国首个获批的基因编辑产品,也是为数不多的真正商业化成功的案例,是非常有代表性的,大家可以了解一下喔。
高油酸大豆
成立于2010年,总部位于美国明尼苏达州的Calyxt公司于2019年推出高油酸大豆,是美国首个获得商业批准的基因编辑产品。经批准,该基因编辑大豆不受转基因植物相关法规的制约,其种植和加工无须批准,也无须满足其他条件。由其生产的大豆油含有80%的油酸、最多含20%的饱和脂肪酸且不含反式脂肪酸,对比普通大豆油中20%的油酸含量并在加工过程中容易产生反式脂肪酸的现象可谓是非常优秀了,而且其油炸使用时间、保质期均比普通大豆油更长。

图5 由Calyxt公司的高油酸大豆生产的大豆油Calyno。图片来源:Retail-today。
Calyxt公司通过TALEN介导的基因编辑技术敲除大豆中的FAD2-1A和FAD2-1B两个基因,检测为阳性的T0代大豆继续种植,收获T1代大豆,得到了纯合突变株系,其含有缺失63bp的FAD2-1A基因、缺失23bp的FAD2-1B基因,前者导致FAD2-1A蛋白缺失21个氨基酸致使蛋白失活,后者导致387个氨基酸的FAD2-1B蛋白变成147个氨基酸的截短蛋白。将包含所需突变的T1代植株继续种植,收获T2代大豆,鉴定出了12个缺乏TALEN T-DNA的株系,这些株系将用于繁殖后代。对这12个株系进行全基因组测序来确认大豆基因组中确实不存在TALEN T-DNA,也不存在脱靶的情况。
2017年,Calyxt公司在纳斯达克上市,目前有三种盈利策略:将TALEN技术授权给其他公司,可自行开发特定性状;将公司开发的特定性状或产品授权给下游合作伙伴,收取特许权使用费;将种子卖给农业加工商或供应链中的其他人。

图6 Calyxt公司的培养间。为什么这家公司要用第二代基因编辑技术TALEN呢?因为该公司的联合创始人、明尼苏达大学教授Dan Voytas是TALEN工具的发明人。该公司其他的明星产品有高油酸/低亚麻酸大豆、高纤维小麦、优质苜蓿、不褐变马铃薯、耐寒燕麦等。图片来源:World-grain。
紫色番茄
接下来,伯小远想讲一讲最近特别火的紫色番茄,和本题目没太大关系,但是紫色番茄看起来让人垂涎欲滴,必须得写一下!伯小远在查资料的时候发现许多报道误把它称为基因编辑产品,在这里要特别提一下,这个是转基因产品喔,与基因编辑无关哈。
2022年9月9日,一种经过基因改造的紫色番茄,经美国农业部批准,从2023年开始能够在美国销售。紫色番茄是英国公司Norfolk Plant Sciences(NPS)的产品。

图7 富含高水平花青素的紫色番茄(Big Purple Tomato)。图片来源:NORFOLK官网。
2008年,该公司的创始人之一Cathie Martin在Nature Biotchnology期刊上发表文章“Enrichment of tomato fruit with health-promoting anthocyanins by expression of select transcription factors”,通过在番茄中表达来自金鱼草的两个基因Del和Ros1,产生了一种具有浓郁紫色果肉的独特番茄。其存储时间是普通番茄的两倍,而且,经过测试,喂食这种紫色番茄的老鼠比吃普通番茄的老鼠寿命长30%。
为何诞生了这么久的紫色番茄才刚刚被批准呢?这是因为2019年美国开始简化基因工程植物的监管程序,将低风险产品排除在现有规则之外。

图8 果实特异性启动子E8分别驱动Del和Ros1基因,转化番茄品种MicroTom,得到T1代株系 (Butelli et al., 2021)。(a)用于转化的双元载体;(b)野生型(上)、Del/Ros1C(中)、Del/Ros1N(下)果实在不同成熟阶段的表型;(c)Del/Ros1N番茄植株表型;(d)成熟的野生型番茄果实和Del/Ros1N番茄果实的整体和横切面。备注1:Del基因编码一个bHLH型转录因子,Ros1基因编码一个MYB型转录因子,均与花青素合成有关。备注2:作者团队得到了四个株系,分别命名为Del/Ros1 C、N、Y、Z,其中Del/Ros1Z中度积累花青素,Del/Ros1C、Del/Ros1Y强烈积累花青素,而Del/Ros1N异常强烈地积累花青素。
列举一些其他获得USDA批准的不受监管的产品:
高纤维小麦:由Calyxt公司使用TALENs技术开发,2018年获批;
可生产高含量Omega-3的荠蓝:由Yield10 Bioscience使用CRISPR技术开发,2017年获批;
耐旱耐盐大豆:由明尼苏达大学使用CRISPR技术开发,2017年获批;
优质紫花苜蓿:由Calyxt公司使用TALENs技术开发,2017年获批;
抗霉小麦:由Calyxt公司使用TALENs技术开发,2016年获批;
不褐变马铃薯:由Calyxt公司使用TALENs技术开发,2016年获批;
糯玉米:由杜邦公司使用CRISPR技术开发,2016年获批;
不褐变蘑菇:由宾夕法尼亚州立大学使用CRISPR技术开发,2016年获批。
性状订制流程
性状订制可分为六个步骤:(1)整体实验方案设计;(2)构建基因编辑载体;(3)使用原生质体验证载体的特异性、脱靶率(可选步骤);(4)将基因编辑载体递送至植物细胞;(5)通过组织培养将经基因编辑后的细胞再生为植株;(6)对得到的编辑植株进行筛选和分型;(7)对编辑植株进行其他检测、评估等。

图9 一种基于基因编辑技术开发粮食作物的方案 (Ishii et al., 2016)。首先设计sgRNAs,在原生质体中验证其特异性及脱靶性(可选),再将其递送至植物细胞后分化出编辑苗,对编辑苗的靶位点进行扩增、测序以确定其编辑形式,后续再进行其他表型检测、安全评估等。
小远叨叨
我国基因编辑育种基础研究积累领先世界,这主要体现在基因编辑技术的发文量以及专利发明量上。任何重大技术的突破都意味着原有固化的格局终将会被打破,所以我们国家有望通过基因编辑技术实现育种的弯道超车。这其实可以类比我国的汽车行业,在燃油车时代落后,但在新能源车时代却处于世界领先地位。国内的科学界也对基因编辑产品持乐观态度,对于将实验成果转化为改善人类健康和生活质量的产品有着极大的热情,但仍需耐心等待...望有志之士能和我们一起投入到这个工作中,欢迎大家和我们交流、合作、并一起进步!
References:
Ahmad S, Tang L, Shahzad R, et al. CRISPR-Based crop Improvements: A Way Forward to Achieve Zero Hunger. J Agric Food Chem. 2021;69(30):8307-8323. doi:10.1021/acs.jafc.1c02653
Butelli E, Titta L, Giorgio M, et al. Enrichment of tomato fruit with health-promoting anthocyanins by expression of select transcription factors. Nat Biotechnol. 2008;26(11):1301-1308. doi:10.1038/nbt.1506
Dong H, Huang Y, Wang K. The Development of Herbicide Resistance Crop Plants Using CRISPR/Cas9-Mediated Gene Editing. Genes (Basel). 2021;12(6):912. Published 2021 Jun 12. doi:10.3390/genes12060912
Gao C. Genome engineering for crop improvement and future agriculture. Cell. 2021;184(6):1621-1635. doi:10.1016/j.cell.2021.01.005
Gu X, Liu L, Zhang H. Transgene-free Genome Editing in Plants. Front Genome Ed. 2021;3:805317. Published 2021 Dec 2. doi:10.3389/fgeed.2021.805317
Hussain A, Ding X, Alariqi M, et al. Herbicide Resistance: Another Hot Agronomic Trait for Plant Genome Editing. Plants (Basel). 2021;10(4):621. Published 2021 Mar 24. doi:10.3390/plants10040621
Ishii T, Araki M. Consumer acceptance of food crops developed by genome editing. Plant Cell Rep. 2016;35(7):1507-1518. doi:10.1007/s00299-016-1974-2
Shah DM, Horsch RB, Klee HJ, et al. Engineering herbicide tolerance in transgenic plants. Science. 1986;233(4762):478-481. doi:10.1126/science.233.4762.478
NO.1好文推荐Historical articles
单倍体育种引领现代种业进入“高铁”时代
育种家看过来——利用基因编辑快速创制雄性不育系
袁隆平爷爷心系的“一系法”,能否实现?
纯系养成——单倍体诱导技术(二)
纯系养成——单倍体诱导技术(一)
如何让植物快速“生娃”?
NO.2伯远生物可提供以下技术服务及设备Technical service
植物性状订制一站式解决方案
人工气候室全周期解决方案
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






