2.1-1粗盐提纯氯碱工业(2.1-1粗盐提纯氯碱工业)
一、粗盐提纯
海水中溶解有大量的食盐,通过蒸发浓缩海水,可以得到大量的粗盐,粗盐中食盐约占80%,还含有其他难溶性杂质(泥沙),以及一些可溶性盐(MgCl2、MgSO4、CaSO4等),泥沙可以通过过滤除去(初中),而可溶性盐一般采用沉淀法除去。
|
杂质离子 |
除杂离子 |
除杂试剂 |
离子反应 |
|
Mg2 |
OH- |
NaOH |
Mg2 2OH- = Mg(OH)2↓ |
|
Ca2 |
CO32- |
Na2CO3 |
Ca2 CO32- = CaCO3↓ |
|
SO42- |
Ba2 |
BaCl2 |
Ba2 SO42- = BaSO4↓ |
|
引入的杂质离子 |
/ |
/ |
/ |
|
Ba2 |
CO32- |
Na2CO3 |
Ba2 CO32- = BaCO3↓ |
|
OH- |
H |
HCl |
OH- H = H2O |
|
CO32- |
H |
HCl |
CO32- 2H = H2O CO2↑ |
【注意】
a、由上表可知,除杂使用的试剂为NaOH、Na2CO3、BaCl2、HCl;
b、实际操作时候,为了保证杂质完全被除去,因此所加入的除杂试剂是稍过量的,因此,还需要将稍过量的除杂试剂除去;
c、四种试剂的添加顺序不固定,只需满足Na2CO3在BaCl2后面加(Na2CO3的作用是除去Ca2 和加入的Ba2 ),以及盐酸最后添加(先过滤再加入盐酸,防止沉淀被盐酸溶解);
d、最后过量的盐酸可以通过加热的方法除去。
二、氯碱工业
粗盐提纯得到纯度较高的氯化钠,是一种重要的化工原料,通过电解饱和食盐水得到氯气、氢气和烧碱,并以它们为原料生产一系列含氯、含钠的化工产品的工业称为氯碱工业。
(1)反应方程式:

(2)实验装置:
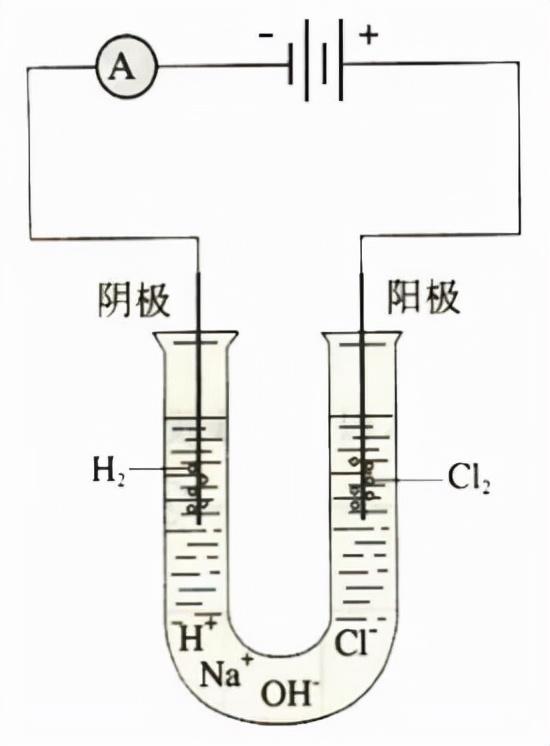

【注意】阴阳极和正负极
a、阴极:得到电子的电极,在电解反应中为和电源负极相连的电极;阳极:失去电子的电极,在电解反应中为和电源正极相连的电极。
b、正极:电源中电子流入(得电子)/电流流出,电势较高的电极;负极:电源中电子流出(失电子)/电流流入,电势较低的电极;
c、正极≠阳极;负极≠阴极,电源才有正负极,实际发生反应产生现象的是在阴阳极。
(3)电极反应和实验现象:
电极反应是指在电极上发生的得到或者失去电子的反应,通常用电极反应式表示,阳极失去电子发生氧化反应,阴极得到电子发生还原反应。
阳极:2Cl- - 2e- = Cl2↑ (氧化反应)
阴极:2H2O 2e- = H2↑ 2OH- (还原反应)
根据阴阳极的电极反应即可写出相应的反应现象:
阳极:产生黄绿色气体,该气体能够使得淀粉碘化钾溶液变蓝色;
阴极:产生无色无味气体,(若点燃该气体,产生淡蓝色火焰),阴极处溶液变红(若滴加酚酞溶液)
(4)该反应的应用:工业制备氯气、氢气和烧碱
(5)该反应的改进:离子交换膜法电解饱和食盐水,原理如下

【注意】
a、水箱中用一层阳离子交换膜隔开,只允许阳离子(Na )通过;
b、右下水中含有少量NaOH的作用是增强溶液的导电性;
【优势】通过阳离子交换膜,使得氯气和氢气在不同的出口生成,从而
a、安全,避免氯气和氢气混合之后见光爆炸;
b、纯净,避免氯气和NaOH接触反应,从而得到较纯的NaOH。
(6)氯碱工业的后续反应:
|
氢氧化钠 |
造纸、玻璃、肥皂、纺织印染 |
|
含氯漂白剂(84等) | |
|
氯气 | |
|
有机合成、氯化物合成、农药 | |
|
盐酸工业 | |
|
氢气 | |
|
有机合成、金属冶炼 |
免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com