蛋白质在细胞合成轨迹 茫茫质海
伯小远想先问大家个问题:单个基因翻译的蛋白是否会定位在不同的亚细胞器上?相信大家给出答案的是——会!那有哪些原因会使蛋白选择换个“家”住呢?今天我们就来一起研究一下吧。读完本文,你会对亚细胞定位实验中出现的很多“反常”情况有更多解释和思考的方向,同时,你将会对以下问题有新的认识:
关于亚细胞定位
subcellular localization
1不同转录本翻译的蛋白是否会影响定位?
2转录因子一定定位在细胞核?
3一个氨基酸的突变就能影响蛋白的定位?
4GFP连在蛋白的N端或C端,蛋白定位的结果一定相同吗?
5蛋白一定是均匀分布在膜上吗?
同一种蛋白在不同亚细胞器定位的原因
NO.1 选择性剪接
与韧皮部发育有关的转录因子基因AtAPL(At1g79430)的选择性剪接将产生两个具有不同5’端的转录本(图1):第一种转录本编码较少的氨基酸,在其末端有一个线粒体靶向序列(MTS),翻译后的蛋白定位于线粒体(图2);第二种转录本编码较多的氨基酸,在其MTS序列的N端还有一段氨基酸,翻译后的蛋白定位于细胞核(图3)。

图1 AtAPL的选择性剪接产生两种转录本 (Duchene & Giege, 2012)。
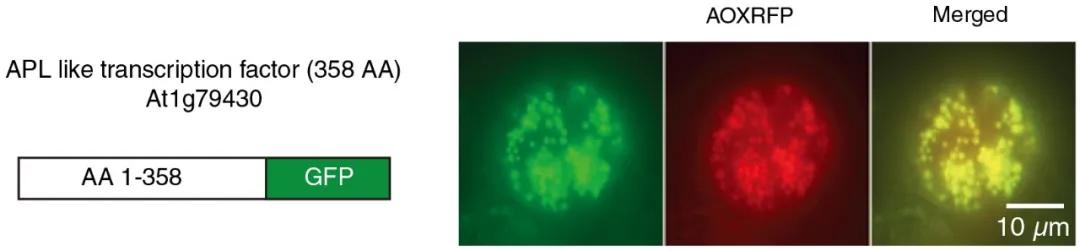
图2 APL编码的较短蛋白质与GFP的N端融合后定位于线粒体 (Carrie et al., 2009)。

图3 APL与APL pro::GFP融合后定位于细胞核 (Bonke et al., 2003)。
NO.2 翻译后修饰:蛋白磷酸化/去磷酸化
栗子一
在植物中,磷酸盐是植物吸收磷的唯一形式,磷的吸收主要由定位于质膜上的磷转运蛋白(Phosphate transporters,PTs)介导,该转运蛋白属于PHOSPHATE TRANSPORTER1(PHT1)转运蛋白家族。蛋白磷酸化是一个可逆的过程,由蛋白激酶和蛋白磷酸酶两种拮抗酶催化。蛋白磷酸酶OsPP95和蛋白激酶CK2拮抗调控PTs的磷酸化状态,影响PTs从内质网向质膜的转运,进而调控植株体内磷的平衡(图4)。由此可见,蛋白的磷酸化状态对蛋白亚细胞定位的影响极其重要。

图4 PP95调节PTs从内质网向质膜转运的信号通路模型 (Yang et al., 2020)。在磷充足的条件下,蛋白激酶CK2全酶(CK2α3与磷酸化的CK2β3一起)使PTs磷酸化,从而抑制它们与磷酸盐转运蛋白运输促进因子PHF1的相互作用,进而抑制其向质膜转运。此外,PHO2会降解PP95,防止其使PTs去磷酸化。因此,质膜上只有很少的PTs。在磷缺乏的条件下,CK2β3被降解,PHO2被下调,使PP95稳定并使PTs去磷酸化。去磷酸化的PT在PHF1的帮助下离开内质网,然后被运输到质膜。因此,就会有更多的PTs靶向质膜,从而有助于磷的吸收。
栗子二
EIN2蛋白是乙烯信号传导过程中的重要蛋白,在乙烯的信号传导中发挥正调控作用。在研究初期,EIN2被发现定位于内质网中(图5)。

图5 EIN2蛋白的亚细胞定位 (Bisson et al., 2009)。(A)EIN2-GFP蛋白;(B)内质网Marker蛋白;(C)将前两张图片重叠;(D)用DAPI染色细胞核;(E)EIN2-GFP显示定位于围绕在细胞核外典型的内质网上;(F)将前两张图片重叠。
2012年8月,Joseph R. Ecker实验室在Science期刊发表了题为“Processing and subcellular trafficking of ER-tethered EIN2 control response to ethylene gas”的文章,揭示了EIN2由内质网到细胞核转移的机制。
该团队通过保守结构域预测,发现在EIN2的C端有一个核定位信号(NLS),那么EIN2可能会定位在细胞核吗?亚细胞定位结果显示使用乙烯前体ACC(1-氨基环丙烷羧酸)处理样品会使EIN2由内质网转移至细胞核(图6)。

图6 乙烯对EIN2亚细胞定位的影响 (Qiao et al., 2012)。在没有使用乙烯前体ACC的情况下,EIN2-GFP定位于内质网(C),但使用ACC处理后,EIN2-GFP定位于细胞核(D),并且随着处理时间的延长(0、10、20、30min),细胞核内会聚集越来越多的EIN2蛋白。
后续的实验表明EIN2是一种双功能的蛋白,当有乙烯存在时,EIN2被蛋白水解酶剪切后,其C端片段(CEND)会转运至细胞核发挥作用,剪切位点位于C端的S645位置(图7),而这其实也是由于CTR1蛋白激酶对EIN2的磷酸化修饰才使EIN2的C端被剪切入核 ( Ju et al., 2012; Qiao et al., 2012; Wen et al., 2012)。

图7 EIN2蛋白的结构 (Li et al., 2015)。EIN2含有7个内含子,其N端具有12个跨膜结构域。后来的研究发现,乙烯-CTR1信号通路中CTR1可以磷酸化EIN2-S645/S924位点(是的,不止正文中所述S645这一个位点噢),并抑制EIN2的C端片段(CEND)的质-核穿梭;当有乙烯时,EIN2-S645/S924位点的磷酸基团被去除,导致EIN2被剪切,EIN2 CEND在核内富集。
现在,伯小远留道思考题:如果我们用EIN2做亚细胞定位实验,将GFP融合在它的N端或C端,一定会得到相同的定位结果吗?S645剪切位点的存在会使蛋白断裂而导致出现不同结果吗?
同学们可以在文章后面留言!
2015年,北京大学郭红卫课题组在Cell期刊发表了题为“EIN2-directed translational regulation of ethylene signaling in Arabidopsis”的文章,揭示了EIN2如何抑制EBF1/2的功能(图8)。对乙烯信号传导感兴趣的同学可以多看一下该实验室的其它文章呦!

图8 乙烯信号传导途径 (Li et al., 2015)。当没有乙烯时,细胞核中的EIN3/EIL1会被F-box蛋白EBF1/2介导的泛素化/蛋白酶体途径快速降解,抑制下游乙烯相关基因的表达。当有乙烯时,EIN2 CEND被蛋白酶从内质网上切割下来,细胞质中的EIN2 CEND可以和EBF1/2 mRNA的3’UTR互作,并且通过和定位于细胞质的P-body中的组分互作,将EBF1/2 mRNA带入P-body,从而抑制EBF1/2 mRNA的翻译,EIN2 CEND进入细胞核,稳定EIN3/EIL1并使其积累,激活下游乙烯信号。
NO.3 翻译后修饰:法尼基化
2008年,Wilhelm Gruissem实验室在Plant Physiology期刊发表了题为“Farnesylation Directs AtIPT3 Subcellular Localization and Modulates Cytokinin Biosynthesis in Arabidopsis”的文章,揭示了AtIPT3由质体到细胞核转移的机制。
蛋白质法尼基化修饰是指在目标蛋白质的羧基末端的CaaX基序的半胱氨酸残基(Cys)上添加15个碳的法尼基异戊二烯。
拟南芥中细胞分裂素生物合成的第一步是由磷酸腺苷-异戊烯基转移酶(AtIPT)催化的。AtIPT3位于质体中,因为该蛋白质的前55个氨基酸是叶绿体转运肽(Transit peptide,TP),该TP足以将GFP引导至质体(图9A)。为了研究法尼基化对AtIPT3亚细胞定位的影响,在洋葱表皮细胞瞬时表达TP-GFP(A)、GFP-AtIPT3C333S(B)、TP-GFP-AtIPT3C333S(C-F)和TP-GFP-AtIPT3(G-M)。AtIPT3包含完整的野生型CLVA基序,AtIPT3C333S是指将CLVA突变为SLVA,即半胱氨酸突变为丝氨酸,导致AtIPT3无法被法尼基化。亚细胞定位结果显示,AtIPT3的法尼基化会将大部分蛋白质导向细胞核(图9)。

图9 法尼基化影响AtIPT3的亚细胞定位 (Galichet et al., 2008)。TP-GFP-AtIPT3C333S定位在质体中(图C-F),而缺乏TP(GFP-AtIPT3C333S)导致蛋白质定位在细胞质中(图B)。相比之下,TP-GFP-AtIPT3在转化后16h主要定位于细胞核(图H-K),然而,在24h后该蛋白也定位于一些细胞的细胞质中(图L、M)。类似地,在转化细胞的细胞核和细胞质中也发现了GFP-AtIPT3。总之,尽管存在叶绿体TP,但AtIPT3的法尼基化会将大部分蛋白质导向细胞核。
NO.4 和其他蛋白的相互作用
2018年,浙江大学毛传澡实验室在New Phytologist期刊发表了题为“Rice SPX6 negatively regulates the phosphate starvation response through suppression of the transcription factor PHR2”的文章,揭示了水稻SPX6蛋白作为磷(Pi)饥饿信号响应途径负调控因子的作用,完善了磷元素响应的信号传导途径。
该团队在烟草叶片中瞬时共表达35S-SPX6-GFP和35S-PHR2-mcherry。结果发现与SPX6-GFP共表达的PHR2-mcherry在细胞核和细胞质中均表达,而在对照组中,PHR2-mcherry主要定位于细胞核(图10c)。这表明与PHR2有相互作用的SPX6改变了PHR2的亚细胞定位,这种改变直接影响了对基因功能的调控(图11)。

图10 SPX6的过表达致使PHR2的亚细胞定位发生改变 (Zhong et al., 2018)。(a)亚细胞定位实验表明SPX6定位在细胞核和细胞质;(b)BiFC实验表明,SPX6和PHR2在细胞核和细胞质中均能发生互作;(c)在烟草叶片中瞬时共表达35S-SPX6-GFP和35S-PHR2-mCherry,发现SPX6可以改变PHR2的亚细胞定位。

图11 SPX4和SPX6调节磷信号的工作模型 (Zhong et al., 2018)。当磷充足时,SPX4和SPX6在细胞质与PHR2结合,抑制PHR2的质-核转移,在细胞核中,SPX6也能与PHR2结合,抑制PHR2对下游PSI基因的激活能力,保持PSI低表达;缺磷时,SPX4和SPX6被泛素化降解,PHR2被释放并进行质-核转移,在核中,与PSI基因启动子上的P1BS基序结合,激活PSI的表达,促进磷的吸收。
NO.5 一个碱基的突变
2019年,湖南农业大学武涛实验室在Journal of Experimental Botany期刊发表了题为“PINOID is required for lateral organ morphogenesis and ovule development in cucumber”的文章,揭示了黄瓜突变体r1中蛋白激酶PINOID(PID)一个氨基酸的突变导致其影响了生长素的转运,进而影响器官形态发生和胚珠发育。
该团队发现突变体r1的CsPID基因第二个外显子上的G突变成了A(图12),该突变位点可能通过改变其蛋白激酶PKD1的活性进而影响CsPID的功能。在烟草叶片中分别瞬时表达pSuper::CsPID-eGFP和pSuper::Cspid-eGFP。结果发现,CsPID以连续模式定位于细胞和细胞核的外围,而Cspid以点状模式定位于细胞和细胞核的外围(图13)。这表明即便是一个碱基的突变带来的氨基酸突变,也会改变蛋白的亚细胞定位并最终影响蛋白的功能。

图12 突变体r1的CsPID基因第二个外显子上的G突变成了A (Liu et al., 2019)。

图13 在烟草叶片中分别瞬时表达pSuper::eGFP、pSuper::CsPID-eGFP和pSuper::Cspid-eGFP (Liu et al., 2019)。
一些“反常”的定位
Q1. 同源蛋白一定定位在相同的亚细胞器?
不一定。倒过来想,同源蛋白就一定发挥相同的功能吗,答案是否定的,那就很好理解同源蛋白为何不一定定位在相同的亚细胞器上了。所以,千万不要用同源蛋白的定位结果来进行假设喔。
Q2. 蛋白一定是均匀分布在膜上吗?
不一定。一些蛋白是有极性的,例如生长素转运蛋白PIN-FORMED(PIN)不对称地定位在质膜上(图14)。类似的,还有其他激素转运蛋白、光受体蛋白、通道蛋白等等。

图14 PIN1在根维管细胞中的定位情况,以及其在中柱鞘(P)和内皮层细胞(En)的定位情况 (Ki et al., 2016)。可以看出,PIN1在细胞质膜上的分布是不均匀的。
Q3. 转录因子一定定位在细胞核?
不一定。前文给出了例子,转录因子AtAPL由于选择性剪接定位于线粒体或细胞核中,我们上一期的文章中也有类似的例子。
伯小远叨叨
再回到开篇提出的问题:单个基因翻译的蛋白是否会定位在不同的亚细胞器上?蛋白亚细胞定位的改变一定伴随着其功能的改变,所以这个问题就等于是问某个蛋白一定只有一种功能吗?在转录水平上,可能由于基因产生了不同的转录本,在翻译水平上,可能由于蛋白受到了各种修饰(磷酸化、乙酰化、泛素化、甲基化、糖基化、法尼基化等,伯小远仅列举了其中两个),这些原因都会使蛋白在改变功能的同时也改变其亚细胞定位,而上述“和其他蛋白的相互作用”、“一个碱基的突变”也包含在这些原因之中,单列出来是为了让大家能记的更深刻。当然,除了这些原因,也可能是多个靶向信号之间的竞争、靶向信号被修改或效率低等,欢迎大家来补充喔!
好 文 推 荐
亚细胞定位的爱恨情仇:核、质之争
最强大脑炼成记——如何验证一个基因是转录因子
【干货】如何做蛋白亚细胞定位实验?
,
免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






