求化合价的运算(化合价的求解方法)
化合物中元素化合价的定义、计算方法、根据元素化合价写出化学式是初中化学学习的基础内容。要熟练掌握。
1、化合价的定义
化合价的定义:不同种原子之间相互化合,构成化合物时,原子得失电子的数目称为化合价。失去电子的为“ ”价,得到电子的为“-”价。
1.1、化合价的产生原理
①化合价的产生:不同种原子之间相互吸引,导致原子最外层电子得失(或偏离)形成带正负电性,产生化合价。
如NaCl中Na与Cl的化合价的产生原理:

②单质的化合价为0
单质为同种元素构成,原子间吸引力相同,没有电子的得失(或偏离),所以单质的化合价为0。
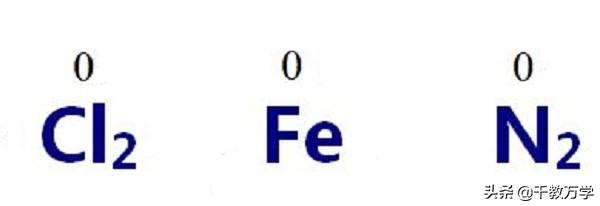

1.2、化合价的标注方法
化合物中的各元素的化合价标注在各自的正上方,正负号写在前,数字写在后面。
” 1“表示正1价;”-2“表示负2价。

1.3、元素化合价取决于原子最外层电子数
①最外层电子数为1、2、3的原子容易失去电子形成稳定结构,一般表现出 1价、 2价、 3价。如:Na、K、Ca、Mg、Al等。

②最外层电子数为6、7的原子容易得到电子形成稳定结构,一般表现出-2价、-1价。如:O、Cl等。

③最外层电子数为4、5的原子既可能得电子也可能失去电子。表现出多种化合价。如:N、C、S等。


1.4、常见化合价
一些原子在组成化合物时,有比较固定的化合价。如Na常表现为 1;O常表现为-2;Ca常表现为 2;H常表现为 1。


1.5、化合物中各元素化合价代数和为0

1.6、常见离子团
初中化学常见的离子团有:

- 离子价与化合价的区别
①离子价:整个离子团所带的电荷数,标注在整个离子团的右上角。电荷数写在前,正负号写在后面,电荷数是1的省略,如“2-”、“-”、“ ”、“3 ”;
②化合价:化合物中一元素的化合价,标注在该元素的正上方,正负号写在前面,电荷数写后前,电荷数是1的不省略,如“-2”、“-1”、“ 3”、“ 1”;

2、化合物中元素化合价的计算方法
2.1、化合物中元素化合价的计算步骤
第1步:找到有固定化合价的元素,并在该元素上方标上元素的化合价;
第2步:将所求元素的化合价设成x;
第3步:各原子的化合价乘以各原子的个数相加等于0;
如求Na2CO3中C元素的化合价

2.1、离子团中元素化合物价的计算方法
第1步:找到有固定化合价的元素,并在该元素上方标上元素的化合价;
第2步:将所求元素的化合价设成x;
第3步:各原子的化合价乘以各原子的个数相加等于离子团所带电荷数;
如求铵根离子(NH4 )中N元素的化合价


2.2、含离子团的化合物中元素化合价的计算方法
如求Na2SO4中S元素的化合价


2.3、化合物中同一元素可能存在两中不同的化合价(Fe3O4和NH4NO3)
①如求Fe3O4中Fe元素的化合价

化合价为分数,显然错误。

②如求NH4NO3中N元素的化合价

正确求解方法(分离成离子团后再求化合价)

3、根据化合价写出化合物的化学式
3.1、化学式的书写方法
①一般显正价的元素放在左边,显负价的元素放在右边,如:

②含离子团的化合物,一般带正电离子团写在左边,带负电离子团写在右边,如:

③化合物中各元素的化合价代数和为0;离子团可看成整体计算。

3.1、氧化钠的化学式(不含离子团)书写方法

3.2、硝酸镁的化学式(含离子团的化合物,离子团看成整体)书写方法

免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com