sars病毒又来了吗(解读SARS)


2003年一场突如其来的疫情对我们国家的卫生系统提出了严峻考验。严重急性呼吸综合征(Severe Acute Respiratory Syndrome,SARS),在国内又称为非典型性肺炎,即人们所熟知的非典。我们从对未知的恐慌和措手不及,再到如今应对新冠疫情时的镇定和有条不紊、快速地做出反应,这其中有无数的经验教训。
我们回顾历史,向大家介绍SARS病毒的病原学、发现过程、SARS的临床特点、危害及救治,以及SARS对公共卫生领域提出的思考。并以此向奋战在一线的医护人员致敬,向优秀的科研工作者致敬!
一、病毒分类学介绍
冠状病毒(coronavirus)属于套式病毒目(Nidovirales)冠状病毒科(Coronaviridae)冠状病毒亚科(Cornidovirineae)。该亚科根据其亲缘关系和基因组结构,由四个属组成:α冠状病毒、β-冠状病毒、γ-冠状病毒和δ-冠状病毒(图1)。

图1. 冠状病毒亚科[1]。(图片来源于参考文献1)
α冠状病毒(紫色);β-冠状病毒(粉色);γ-冠状病毒(绿色)和δ-冠状病毒(蓝色)。红色箭头所指为SARS-CoV。
冠状病毒感染动物和人。目前从人分离的冠状病毒主要有普通冠状病毒NL63、 229E、OC43、HKUl、SARS 冠状病毒 (severe acute respiratory syndrome coronavirus,SARS-CoV)和中东呼吸综合征冠状病毒 (middle east respiratory syndrome coronavirus,MERS-CoV) 六个型别。MERS-CoV可能至少在30年前从蝙蝠传播到单峰骆驼[2],此后一直流行于单峰骆驼。HCoV-229E和HCoV-NL63通常在具有免疫能力的人类中引起轻度感染。最近在非洲蝙蝠[3,4]中发现了这些病毒的祖先,而骆驼科动物很可能是HCoV-229E[4,5]的中间宿主。HCoV-OC43和HKU1都对人体无害,很可能起源于啮齿动物[6,7]。

图2. 人冠状病毒的动物起源。(图片来源于参考文献1)
实线箭头表示已确认的数据。黑色箭头表示在中间动物中感染,黄色箭头表示在人类中轻度感染,红色箭头表示在人或动物中严重感染。
SARS-CoV属于β-冠状病毒。研究认为蝙蝠可能是β冠状病毒的自然储存宿主[8]。SARS-CoV是一种新的冠状病毒,是通过蝙蝠SARS相关冠状病毒(SARSr-CoVs)重组产生的。重组病毒感染了小动物和人类,并在导致SARS流行之前适应了这些宿主[9,10]。一项为期5年的纵向研究表明,在中国云南省一个洞穴的蝙蝠种群中存在高度变异的SARSr-CoV [11,12,13]。这个地方的SARSr-CoV包含中国其他地方发现的所有的SARSr-CoV的遗传多样性。此外,在这一位置存在的病毒株包含形成SARS-CoV所需的所有遗传元件。由于在SARS爆发期间云南省没有SARS病例,因此研究人员假设SARS-CoV的直接祖先是通过蝙蝠内的病毒重组产生的,然后传播到养殖的果子狸或其他哺乳动物。且该病毒在扩散给人类之前获得了进一步的突变[1]。
二、病原学特征
冠状病毒由于病毒包膜上有向四周伸出的突起,形如花冠而得名。是基因组最大的RNA病毒。
SARS病毒粒子呈不规则形状,直径约80-250 nm。病毒粒子外包着脂肪膜,膜表面有三种糖蛋白[14,15,16]:刺突糖蛋白(spike protein,S,是受体结合位点、溶细胞作用和主要抗原位点)、小包膜糖蛋白(envelope protein,E,较小,与包膜结合的蛋白)、膜糖蛋白(membrane protein,M,负责营养物质的跨膜运输、新生病毒出芽释放与病毒外包膜的形成)。SARS病毒的核酸为非节段单链( )RNA[17],长27-32 kb。具有正链RNA特有的重要结构特征:即RNA链5’端有甲基化“帽子”,3’端有PolyA “尾巴”结构。这一结构与真核生物的mRNA非常相似,SARS 病毒基因组可以直接作为mRNA ,翻译合成相关的功能蛋白和结构蛋白[18]。
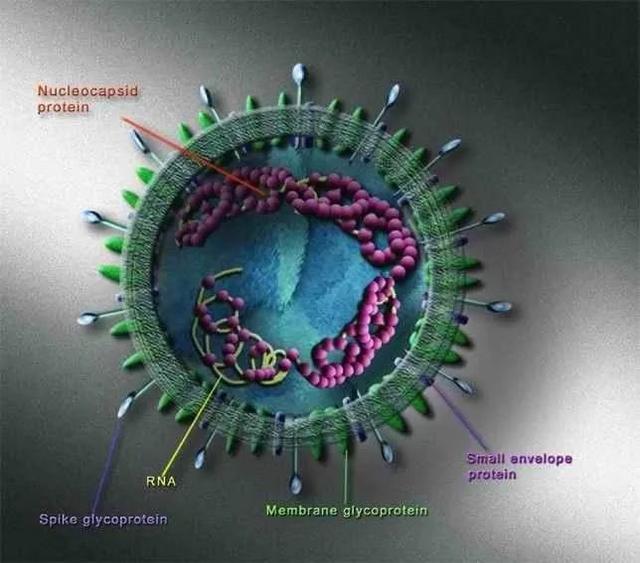
图3. SARS-CoV结构示意图(图片来源于网络)
三、传染病防控等级
《人间传染的病原微生物名录》[19]将人间传染的病原微生物按危害程度可分为四类,其中第一类(如天花病毒等)危害程度最高。SARS-CoV属于危害程度第二类,指能引起人或动物严重疾病,比较容易直接或者间接在人与人、动物与人、动物与动物间传播的微生物。需要在BSL-3及以上实验室开展研究。可感染人类的高致病性病原微生物是指在《人间传染的病原微生物名录》中规定的第一类、第二类病原微生物。
在《中华人民共和国传染病防治法》中将传染病分为三类,主要为甲类、乙类和丙类。甲类传染病主要是鼠疫和霍乱,为强制管理的烈性传染病。乙类传染病是严格管理的传染病。SARS属于乙类传染病,按照甲类管理。
四、SARS病毒的发现
2002年11月16日,我国广东省佛山市发现首例不明原因肺炎,随后在该省的河源、中山、广州等地又出现类似病例,其中包括几起医护人员感染病例。
2003年2月3日至14日,广东发病进入高峰,总共向世界卫生组织(WHO)报告患者305例,死亡5例,其中医务人员感染发病共105例 。
2月18日中国疾病研究中心病毒研究所通过电镜从两例尸解标本中发现衣原体,宣布广东非典型肺炎病原基本确定为衣原体[20]。当天下午广东省卫生厅召开紧急会议,以钟南山为首的专家组均认为,不能简单地认定衣原体就是唯一的病原[21]。
3月12日,WHO正式发出该流行病的全球警报,15日正式将该病命名为严重急性呼吸综合征(Severe Acute Respiratory Syndrome,SARS)。而此后,加拿大和新加坡都报道了类似病例的出现。
3月17日WHO联合全球9国11个实验室组成联合网络,协作攻关,查找SARS病原[22]。
3月18-22日,联合网络中若干实验室提出SARS的病原可能是副黏液病毒[23];3月19日,WHO宣布检测显示导致SARS的病原体不同于人类已知的病毒与细菌,很可能是一种未知的新病原体。
直至28日,香港大学首先宣布已从患者组织标本中分离出冠状病毒,并推测为致病病原[24],但该报道未引起广泛注意。
截至4月11日,中国CDC、军事医学科学院等相关实验室证实在SARS病原研究中发现了冠状病毒[25,26],此时全球已倾向于认为冠状病毒为引发SARS的元凶。
4月13日加拿大BC肿瘤研究所基因组科学中心首先完成了该病毒的全基因组测序[27];16日荷兰科学家成功建立冠状病毒实验的动物模型[28],终于确证了导致全球肆虐的SARS病症由一种新型冠状病毒引发,当天,WHO基于上述研究成果,在日内瓦正式宣布一种新型冠状病毒为SARS的病原,并命名为SARS-CoV。
五、SARS病毒的传播
SARS主要通过呼吸道飞沫传播。因在急性期患者咽拭子、痰标本中检测出较高含量的SARS病毒[29,30],故认为飞沫或气溶胶是SARS病毒的主要传播途径。特别是为危重患者行气管插管、气管切开的医护人员易暴露于上述环境中。而香港淘大花园的暴发流行事件则显示SARS-CoV可能通过粪口途径传播[31]。
在SARS病毒传播过程中,多次出现“超级传播者”——WHO提出,把病毒传染给十人以上的病人被称为超级传播者。2003年2月21日,孙逸仙纪念医院的一位退休人员到达香港并入住香港京华国际酒店,后确诊为非典患者并传染给同一楼层多名旅客,旅客归国后陆续发病,由此揭开了SARS全球流行的序幕[32]。
2月下旬,越南河内发现首例患者,患者曾短暂逗留香港,随后河内当地医院多名医务人员受到感染,常驻河内的WHO Dr. Carlo Urbani参与了当地患者的抢救治疗,并向WHO报告当地病情,首次将该病命名为SARS,随后因受感染于3月29日去世[33],这是国外首例SARS的报告。而国内3月初在北京、台湾等地均接报了第一例输入性非典病例[34],3月10日香港媒体通报威尔斯亲王医院出现10多名医护人员感染病例,并发现该病具有传染性[32]。
此后SARS在全球范围内迅速传播。WHO的统计数据显示,2002年11月1日至2003年7月31日期间,SARS波及亚洲、欧洲、非洲、大洋洲、北美洲的29个国家及地区,全球SARS-CoV感染人数共8096例,其中死亡774例,死亡率为9.56%;中国大陆共感染5327例,死亡349例,死亡率6.6%[35]。
六、SARS的疾病特点、危害、救治及疫苗研究
SARS早期在国内爆发时,各界人士异常重视。其中杰出代表——中国工程院院士钟南山主动冲击在抗疫前线,并担任广东省非典医疗救护专家指导小组组长。面对权威部门的衣原体肺炎报告,钟院士力排众议,本着实事求是的精神,坚持己见,认为不能简单地认定衣原体就是唯一的病原。并率领团队通过实践治疗,总结出“三早三合理”的诊疗原则[36],为抗击非典疫情做出了重要贡献。钟院士是我国当之无愧的非典抗疫英雄。

图4.钟南山院士(左)
1. SARS-CoV受体ACE2
当时在Brigham and Women's Hospital工作的李文辉博士首先发现,血管紧张素转换酶2(ACE2)是SARS-CoV刺突蛋白(S蛋白)的功能性受体[37]。SARS的S蛋白与细胞表面的ACE2结合,诱导细胞内吞病毒。病毒侵入细胞后再释放自身遗传物质RNA,进行复制增值[38]。
表达ACE2的细胞在人体中分布广泛,其中以肺泡上皮细胞和小肠上皮细胞表达最为显著,这也就解释了为什么SARS-CoV主要通过呼吸道传播,且损伤以肺部为主[39]。

图5. SARS-CoV由ACE2介导入胞(图片来源于参考文献38)
2. SARS症状及危害
疾病的临床症状个人差别很大,从症状轻微到严重的呼吸衰竭和死亡不等。SARS的主要临床表现可以概括为为:一烧二痛三干咳,肺部实变呼吸难。
SARS潜伏期一般为2-11天,患者则不表现出症状。发病初期症状与一般的流感极为相似。患者首先表现出发热,多高于38℃,可出现畏寒,多数患者还会出现头痛、肌肉、关节酸痛等症状,部分患者伴有腹泻。发病3-7天后,会出现干咳现象,痰液较少,可能伴有胸痛。此外,SARS患者外周血中的淋巴细胞数目往往不升反降[31]。
SRAS冠状病毒可以侵入肺泡上皮,引起肺泡上皮细胞坏死。病毒的结构蛋白还可以使机体产生超敏反应,而过强的炎症反应导致白细胞大量聚集,白细胞释放的细胞毒性物质不仅可以清除被病毒感染的细胞,还可破坏周围正常细胞。因此SARS常常导致肺组织受到损伤,导致肺泡上皮坏死剥脱。
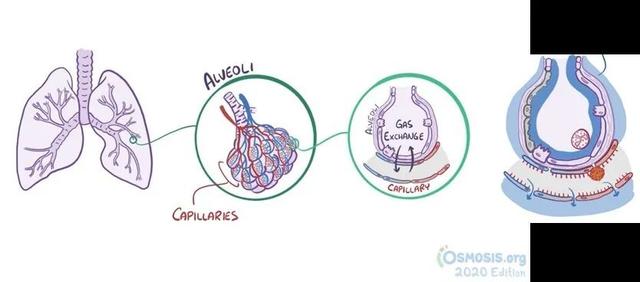
图6. 正常肺脏及肺水肿示意图(图片来源于网络)
病情进一步发展,患者可出现呼吸困难的症状,严重者可发展为急性呼吸窘迫综合征(ARDS)。那ARDS又是什么呢?如图所示,正常的肺脏中,支气管像树枝一样分出枝桠,末端则是形成无数葡萄样的小气腔,即肺泡(alveoli)。这些肺泡表面被毛细血管(capillary)包绕,肺泡壁和毛细血管壁之间还夹着一层基底膜。气体可以通过这几层屏障,血管中的CO2可以排入肺泡,肺泡中吸入的O2可以进入血液,从而实现气体交换,满足人体代谢需求。血管中的其他成分一般不会透过这些屏障。而当病毒入侵,局部出现炎症反应时,大量炎症因子导致毛细血管扩张,血管中水和蛋白质可以通过扩大的“间隙”渗出,进入肺泡和肺间质,与坏死脱落的肺泡上皮混在一起。这时患者吸气,肺泡中的液体便会被气体压到肺泡表面,铺开成一层透明膜,严重一些的肺泡可能被液体充满,这也就是所谓的肺水肿。肺水肿会导致患者呼吸困难,且气体也不易透过屏障进行交换,血液中氧含量降低,因此患者常常表现出缺氧症状,严重者甚至会出现休克。肺间质中的红细胞也可漏出血管,表现为局部出血,患者可能出现血痰、咯血等症状。正常的肺组织像海绵一般充满气体,而水肿的肺组织则是实心的,因而在X线检查肺部时会出现实变阴影[40]。
除了肺脏,强烈的免疫反应还可能导致脾、淋巴结、心、肝、肾、肾上腺等全身多器官出现出血及坏死,引起全身性的器官衰竭。
3. SARS的治疗
对于SRAS的治疗包括综合性的支持治疗与对症治疗。支持疗法主要包括补充营养如水分、维生素等、对缺氧者及时给予吸氧、对发生呼吸窘迫综合征患者适当使用人工呼吸机等[41]。对症治疗主要包括:在体温过高,超过38.5℃时,或疼痛严重时,可使用解热镇痛药;在无痰干咳频繁的情况下,可使用止咳药;为防止继发细菌感染,可使用大环内酯类抗生素;对炎症反应严重的患者,可使用肾上腺皮质激素,如甲泼尼龙。此外,还可使用抗病毒药,如利巴韦林、干扰素等。中药也可用于辅助治疗[41,42]。
正如人们对疾病的认识在不断更新,临床治疗技术也是在不断发展的。ECMO俗称人工膜肺、叶克肺,是体外膜肺氧合(Extracorporeal Membrane Oxygenation)的英文缩写。其基本原理为利用体外循环替代人体自然循环, 有离心泵提供血流动力, 通过氧合器 (核心部分) 对静脉血进行氧合, 清除CO2, 成为血氧浓度高和CO2浓度低的动脉血后注入人体[43]。简言之,ECMO以机器代替肺,为患者提供了长时间的心肺支持,为一些心肺衰竭、重症缺氧患者的抢救赢得了宝贵时间。

图7. ECMO(图片来源于网络)
我国EMCO技术起步较晚[44],2003年SARS肆虐时,ECMO还不曾广泛使用。2004年底时, 全世界仅有100多家医院应用EMCO技术,而且主要集中在西方发达国家[45]。而近些年来ECMO在中国迅速发展(如图7所示),被广泛用于呼吸衰竭患者的治疗[46]。如今在应对新冠肺炎疫情时,ECMO已经频频出现在公众视野中,挽救了许多患者的生命。

图8. 2011年至2015年我国开展EMCO的医院数量及治疗例数(图片来源于参考文献41)
4. 有关 SARS疫苗
冠状病毒疫苗的研制是目前学界的研究热点之一。疫苗有多种类型,包括亚单位疫苗、灭活疫苗、载体疫苗和减毒活疫苗等,每种疫苗都有其独特的优点和局限性。然而对于SARS-CoV的疫苗研究困难重重。在进行临床实验之前,需要用动物进行实验,而目前还没有为SARS-CoV建立合适的动物模型。目前研究常使用HCoV-229E、HCoV-OC43感染转基因小鼠进行相关研究,然而没有小鼠模型可以很好地兼顾人体感染、发病机制及体内病理变化的模拟[47]。此外,SARS疫情来去匆匆,即使疫苗进入了临床试验阶段可能也没有合适的环境来检验其效果。我们相信随着科技的进步,疫苗的研发速度会跟上疫情的脚步,并为对抗疫情做出重要贡献!下面对研究中的几种SARS-CoV疫苗进行简述。
4.1. 亚单位疫苗
亚单位疫苗仅保留与激发保护性免疫反应有关的病毒成分,去除病毒其他成分。研究表明,含有SARS-CoV的S蛋白和流感病毒蛋白的嵌合病毒样颗粒(VLPs)可保护小鼠免受SARS-CoV的攻击,诱导免疫反应[49]。由于该疫苗不含活病毒及病毒核酸,因此较为安全[48]。然而其只含有病毒的部分成分,不代表病毒的全部抗原,因此疫苗的保护效果有限[47]。
4.2. 灭活疫苗
灭活疫苗又称死疫苗,是将培养的SARS-CoV用理化方法灭活制成。许多由化学灭活的SARS-CoV疫苗已经在仓鼠、小鼠、雪貂等动物模型中进行实验,均显示出不同水平抗体的产生[47]。然而由于灭活病毒无法侵入细胞内,因此免疫效果有一定局限性[48]。此外,灭活SARS-CoV存在引起机体超敏反应的风险,也存在潜在传染的风险[47]。
4.3. 载体疫苗
载体疫苗将编码SARS-CoV的部分基因转入毒力不是很强的病毒载体中,再使这种重组病毒感染人体,在体内表达出SARS-CoV 的蛋白以产生免疫反应。目前痘病毒、腺病毒、麻疹病毒等已被用于研制SARS-CoV疫苗,然而其实际效果还有待评估[47]。载体疫苗的弊端和亚单位疫苗类似,即仅提供病毒的部分抗原位点,保护效果有限。
4.4. 减毒活疫苗
减毒活疫苗使用毒性减弱的或无毒力的SARS-CoV制成。现多使用基因编辑技术,使病毒编码毒力蛋白的基因缺失或对其进行修饰,从而降低或消除毒力。目前已在HCoV-229E、HCoV-OC43和HCoV-NL63等冠状病毒家族成员中展开实验[47]。减毒活疫苗中的病毒在体内有一定的繁殖能力,免疫效果良好且持久[48]。然而需要防止疫苗接种后,病毒突变回复到高毒性状态。
七、SARS对公共卫生方面提出的思考
经历了一场SARS危机,我们不得不对重大传染病防控所涉及的诸多领域引起重视。2003年5月,国务院颁布《突发公共卫生事件应急条例》,规范了我国对重大疫情的应急响应。2004年,我国针对SARS流行过程中暴露出的疾病监测系统敏感性和实效性差的问题,彻底改变了公共卫生监测(包括传染病监测)的报告方式,建立了传染病网络直报系统[50]。而针对SARS流行期间大量医护人员被感染的情况,人们也注意到院感防控不能再流于形式,而必须规范化、日常化,要提高院感管理水平,更好地保护医务人员和患者。
SARS暴发之时,中国疾控中心(CDC)尚且年幼,公共卫生体系脆弱无力。虽经多年建设,在此次新冠疫情期间,疾控中心的话语权和公共卫生的重要性仍然是值得重视的话题。
另外,SARS还给公众敲响了警钟:当某地暴发疫情,在人员的聚集和流动下,其他任何地方都不是绝对安全无虞的。正是因为经历过SARS的考验,在新冠疫情暴发之时,绝大部分居民都提高了防护意识,自觉居家隔离,为战“疫”做出了贡献。
人类对新发传染病的认识是一个循序渐进的过程。面对未知,我们会恐慌和措手不及,但是在许许多多医务人员和科研工作者的共同努力下,我们相信,未知终将成为已知。我们走过的迷途,都将为我们积攒下宝贵的经验、坚定我们必胜的信心,并在与病原体一次又一次的斗争中,指导我们取得最终的胜利。面对新发突发疫情大流行,没有谁能够“独善其身”,我们全人类应当团结起来,携手应对。相信科学、实事求是、临危不惧、敢医敢言!
参考文献:
[1]. Cui J, Li F, Shi ZL. Origin and evolution of pathogenic coronaviruses. Nat Rev Microbiol. 2019;17(3):181‐192. doi:10.1038/s41579-018-0118-9
[2]. Müller MA, Corman VM, Jores J, et al. MERS coronavirus neutralizing antibodies in camels, Eastern Africa, 1983-1997. Emerg Infect Dis. 2014;20(12):2093‐2095. doi:10.3201/eid2012.141026
[3]. Huynh J, Li S, Yount B, et al. Evidence supporting a zoonotic origin of human coronavirus strain NL63. J Virol. 2012;86(23):12816‐12825. doi:10.1128/JVI.00906-12
[4]. Tao Y, Shi M, Chommanard C, et al. Surveillance of Bat Coronaviruses in Kenya Identifies Relatives of Human Coronaviruses NL63 and 229E and Their Recombination History. J Virol. 2017;91(5):e01953-16. Published 2017 Feb 14. doi:10.1128/JVI.01953-16
[5]. Corman VM, Eckerle I, Memish ZA, et al. Link of a ubiquitous human coronavirus to dromedary camels. Proc Natl Acad Sci U S A. 2016;113(35):9864‐9869. doi:10.1073/pnas.1604472113
[6]. Su S, Wong G, Shi W, et al. Epidemiology, Genetic Recombination, and Pathogenesis of Coronaviruses. Trends Microbiol. 2016;24(6):490‐502. doi:10.1016/j.tim.2016.03.003
[7]. Forni D, Cagliani R, Clerici M, Sironi M. Molecular Evolution of Human Coronavirus Genomes. Trends Microbiol. 2017;25(1):35‐48. doi:10.1016/j.tim.2016.09.001
[8]. Woo PC, Lau SK, Lam CS, et al. Discovery of seven novel Mammalian and avian coronaviruses in the genus deltacoronavirus supports bat coronaviruses as the gene source of alphacoronavirus and betacoronavirus and avian coronaviruses as the gene source of gammacoronavirus and deltacoronavirus. J Virol. 2012;86(7):3995‐4008. doi:10.1128/JVI.06540-11
[9]. Song HD, Tu CC, Zhang GW, et al. Cross-host evolution of severe acute respiratory syndrome coronavirus in palm civet and human. Proc Natl Acad Sci U S A. 2005;102(7):2430‐2435. doi:10.1073/pnas.0409608102
[10]. Chinese SARS Molecular Epidemiology Consortium. Molecular evolution of the SARS coronavirus during the course of the SARS epidemic in China. Science. 2004;303(5664):1666‐1669. doi:10.1126/science.1092002
[11]. Ge XY, Li JL, Yang XL, et al. Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor. Nature. 2013;503(7477):535‐538. doi:10.1038/nature12711
[12]. Hu B, Zeng LP, Yang XL, et al. Discovery of a rich gene pool of bat SARS-related coronaviruses provides new insights into the origin of SARS coronavirus. PLoS Pathog. 2017;13(11):e1006698. Published 2017 Nov 30. doi:10.1371/journal.ppat.1006698
[13]. Wang MN, Zhang W, Gao YT, et al. Longitudinal surveillance of SARS-like coronaviruses in bats by quantitative real-time PCR. Virol Sin. 2016;31(1):78‐80. doi:10.1007/s12250-015-3703-3.
[14]. Marra MA, Jones SJ, Astell CR, et al. The Genome sequence of the SARS-associated coronavirus. Science. 2003;300(5624):1399‐1404. doi:10.1126/science.1085953
[15]. Peiris JS, Lai ST, Poon LL, et al. Coronavirus as a possible cause of severe acute respiratory syndrome. Lancet. 2003;361(9366):1319‐1325. doi:10.1016/s0140-6736(03)13077-2
[16]. Rota PA, Oberste MS, Monroe SS, et al. Characterization of a novel coronavirus associated with severe acute respiratory syndrome. Science. 2003;300(5624):1394‐1399. doi:10.1126/science.1085952
[17]. Kuiken T, Fouchier RA, Schutten M, et al. Newly discovered coronavirus as the primary cause of severe acute respiratory syndrome. Lancet. 2003;362(9380):263‐270. doi:10.1016/S0140-6736(03)13967-0
[18]. 王瑞琳. SARS冠状病毒分子生物学研究进展[C]. 中国畜牧兽医学会、四川农业大学.中国畜牧兽医学会家畜传染病学分会第六届全国会员代表大会暨第11次学术研讨会论文集.中国畜牧兽医学会、四川农业大学:中国畜牧兽医学会,2005:44-47.
[19]. 卫生部.《人间传染的病原微生物名录》[S]. 2006.
[20]. 洪涛,王健伟,等.电镜观察从非典型肺炎患者尸检标本中发现衣原体样和冠状病毒样颗粒[J].中华医学杂志,2003(08):20-24.
[21]. 张乐人,李士燕.站在抗击非典最前沿——记中国工程院院士、广东省非典型肺炎医疗救护专家指导小组组长钟南山[J].中国人才,2003(05):59-61.
[22]. 中外查找SARS病原体大事记[J].统计与预测,2003(02):36.
[23]. World Health Organization. Update 4 - Severe Acute Respiratory Syndrome ( SARS ) [EB]. [2003-3-19]. https://www.who.int/csr/sars/archive/2003_03_19/en/
[24]. 港大教授发现:非典型肺炎病毒为冠状科病毒[J].中国科技财富,2003(04):96.
[25]. 祝庆余,秦鄂德,等.非典型肺炎病例标本中新型冠状病毒的分离与鉴定[J].中国生物工程杂志,2003(04):106-112.
[26]. 李德新,于建石,等.在传染性非典型肺炎患者组织和血液中发现冠状病毒[J].病毒学报,2003(02):97-99.
[27]. Rota PA, Oberste MS, Monroe SS, et al. Characterization of a novel coronavirus associated with severe acute respiratory syndrome. Science. 2003;300(5624):1394‐1399.
[28]. Fouchier RA, Kuiken T, Schutten M, et al. Aetiology: Koch's postulates fulfilled for SARS virus. Nature. 2003;423(6937):240.
[29]. Poutanen SM,Low DE,Henry B, et al. Identification of severe acute respiratory syndrome in Canada.[J]. Pubmed,2003,348(20).
[30]. Ksiazek TG, Erdman D, et al. A Novel Coronavirus Associated with Severe Acute Respiratory Syndrome[J]. New England Journal of Medicine,2003,348(20)
[31]. Bernd Sebastian Kamps, Christian Hoffmann. SARS Reference. [DB/OL]. (2003-10-17) [2020-05-13] http://www.SARSreference.com
[32]. 秦如丽.香港抗击非典的日日夜夜[J].四川统一战线,2003(06):11-13.
[33]. Reilley Brigg,Van Herp Michel,et al. SARS and Carlo Urbani.[J]. The New England journal of medicine,2003,348(20).
[34]. 常寒婴.非典大事摘编[J].中国减灾,2003(02):47-53.
[35]. World Health Organization. Summary of probable SARS cases with onset of illness from 1 November 2002 to 31 July 2003[EB]. [2020-5-13]. https://www.who.int/csr/sars/country/table2004_04_21/en/
[36]. 张先贤.钟南山在抗击“非典”斗争中的重要贡献[J].广西社会主义学院学报,2003(04):43-44.
[37]. Li W, Moore MJ, Vasilieva N, et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature. 2003;426(6965):450‐454. doi:10.1038/nature02145
[38]. Adedeji AO, Severson W, Jonsson C, Singh K, Weiss SR, Sarafianos SG. Novel inhibitors of severe acute respiratory syndrome coronavirus entry that act by three distinct mechanisms. J Virol. 2013;87(14):8017‐8028. doi:10.1128/JVI.00998-13
[39]. Hamming I, Timens W, Bulthuis ML, Lely AT, Navis G, van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol. 2004;203(2):631‐637. doi:10.1002/path.1570
[40]. 步宏, 李一雷. 病理学[M]. 9版. 北京:人民卫生出版社, 2018: 188-200.
[41]. 照日格图. 严重急性呼吸综合征患者治疗概况及展望[C]. .中华医学会系列杂志SARS研究论文集.:中华医学会,2003:30-31.
[42]. 曹洪波.严重急性呼吸综合征的诊治现状[J].湖北民族学院学报(医学版),2003(03):40-41.
[43]. 李静,顾汉卿.体外膜肺氧合在SARS治疗的应用前景[J].透析与人工器官,2005(02):10-14.
[44]. 赵举,黑飞龙,李斌飞,段大为,侯晓彤,李欣,詹庆元,龙村.中国体外生命支持临床汇总报告[J].中国体外循环杂志,2011,9(01):1-5.
[45]. 龙村.体外膜肺支持疗法在本世纪中国体外循环的机遇和挑战[J].中国体外循环杂志,2005(02):65.
[46]. 章晓华,庄建.中国体外膜肺氧合技术开展的现状及思考[J].中国体外循环杂志,2017,15(02):68-71 91.
[47]. Enjuanes L, Zuñiga S, Castaño-Rodriguez C, Gutierrez-Alvarez J, Canton J, Sola I. Molecular Basis of Coronavirus Virulence and Vaccine Development. Adv Virus Res. 2016;96:245‐286. doi:10.1016/bs.aivir.2016.08.003
[48]. 曹雪涛. 医学免疫学[M]. 7版. 北京: 人民卫生出版社, 2018:214-216.
[49]. Liu YV, Massare MJ, Barnard DL, et al. Chimeric severe acute respiratory syndrome coronavirus (SARS-CoV) S glycoprotein and influenza matrix 1 efficiently form virus-like particles (VLPs) that protect mice against challenge with SARS-CoV. Vaccine. 2011;29(38):6606‐6613. doi:10.1016/j.vaccine.2011.06.111
[50]. 詹思延. 流行病学[M]. 8版. 北京:人民卫生出版社, 2017: 205.
此作品由科技部引进国外智力管理司推荐
来源:北京大学基础医学院 病原生物学系 鲁凤民教授团队、广州呼吸疾病研究所、北京大学医学部、广州医科大学
作者:彭思雯、张依、赵唯、赵月
编辑:吴桐
审核:王飞
<公众号ID:kepuing>

免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






