陈策实团队发现抗氧化应激不依赖氧化磷酸戊糖途径(陈策实团队发现抗氧化应激不依赖氧化磷酸戊糖途径)
戊糖磷酸通路是重要的葡萄糖代谢分支,分为氧化磷酸化(oxPPP)和非氧化磷酸化(non-oxPPP)两个阶段。戊糖磷酸通路产生的5-磷酸核糖和NADPH,在核苷酸、脂肪酸合成以及维系细胞内氧化还原稳态具有重要生物作用。6-磷酸葡萄糖脱氢酶(G6PD)是氧化磷酸戊糖途径(oxPPP)中的第一个限速酶,其在氧化6-磷酸葡萄糖时生成的NADPH是胞质内还原当量的重要来源。在肿瘤中围绕G6PD脱氢酶活性的功能研究已被大量报道【1,2】。从遗传上看,人群中有着一定比例的G6PD酶活突变携带者(蚕豆病)【3】,但目前为止并无G6PD基因完全缺失的相关病例报道;推测完全缺失G6PD的生物体无法正常发育或存活,这提示G6PD可能存在有别于传统酶活的重要生物学功能。
2021年2月4日,首都医科大学李兵辉和中科院昆明动物研究所陈策实课题组在Signal transduction and targeted therapy杂志在线发表了题为Glucose-6-phosphate dehydrogenase neutralizes stresses by supporting reductive glutamine metabolism and AMPK activation 的研究成果【4】,揭示了葡萄糖6磷酸脱氢酶(G6PD)通过促进谷氨酰胺还原代谢维持NADH/NAD 平衡以及AMPK的活化,从而发挥抗氧化等应激的作用,并不依赖它的经典酶活性,即氧化磷酸戊糖途径。

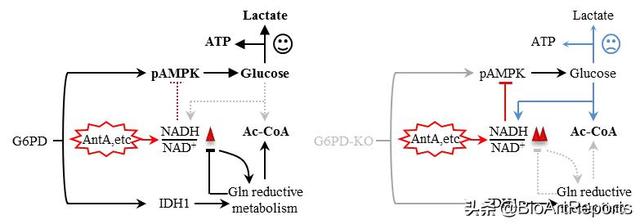
在这项研究中,研究人员发现敲除G6PD的肿瘤细胞对缺氧、氧化应激等刺激极度敏感,这与以往报道一致。意外的是,存在天然蚕豆病突变体,即使没有活性维持正常的脱氢酶活性和oxPPP,也与野生型G6PD一样、甚至有更好的抗氧化应激能力以维持细胞存活。研究人员发现这与G6PD传统酶活耦联的NADPH产生无必要关系,而与细胞内NADH/NAD 稳态的维持密切相关。最近,李兵辉团队建立了一个电子平衡模型揭示了oxPPP在缺氧和呼吸链抑制下会被抑制并代偿增强non-oxPPP【5】;同时还发现细胞可以全面重新编程其代谢途径,如葡萄糖发酵和还原性谷氨酰胺代谢,通过促进电子传递来减轻应激刺激【6】。与之相似,研究人员通过代谢组学分析发现敲除G6PD的肿瘤细胞中NADH/NAD 比例异常升高,谷氨酰胺还原性代谢途径受到明显抑制。与广泛报道的NADPH/NADP 在细胞抗氧化应激中起主要作用不同,研究者发现利用化合物α酮戊二酸、丙酮酸等处理,或表达工具酶LbNOX恢复NADH/NAD 稳态,而不是NADPH/NADP ,能有效提升G6PD缺失细胞的抗氧化应激能力。进一步研究发现,电子传递链抑制剂AntiA处理能诱导野生型肿瘤细胞AMPK T172磷酸化以对抗应激,而在G6PD缺失细胞中AMPK的活化则被显著延迟。同样,使用AMPK激动剂AICAR则能显著提升G6PD缺失细胞应对氧化应激的能力。
总的来说,研究人员发现G6PD可以支持还原性谷氨酰胺代谢以维持NADH/NAD 稳态以及AMPK信号的激活,这对于细胞抵抗过氧化氢、缺氧和抑制电子传递链所引起的应激等是必不可少的。有趣的是,与野生型G6PD相似,存在天然蚕豆病突变体G6PD,即使丧失活性,亦能有效地恢复谷氨酰胺的还原性代谢和AMPK激活来拮抗应激。该研究揭示了之前未被明确的G6PD的功能,这些功能在肿瘤细胞抗氧化应激中具有重要意义,而与其oxPPP酶活性抗氧化机制完全不同。该发现将有助于更好地理解G6PD的生理作用及其与人类疾病的关系。
该项工作李兵辉教授和陈策实研究员为论文共同通讯作者,天津医科大学钟本富博士和中科院昆明动物研究所蒋德伟副研究员为本文共同第一作者,技术员洪阳、李立方博士和博士生阳荣辉等也有重要贡献;清华大学国家蛋白质中心刘晓惠教授团队对本研究代谢组学提供了技术支持和帮助。
原文链接:
https://www.nature.com/articles/s41392-020-00399-x#article-info
制版人:十一
参考文献
1. Chen L, Zhang Z, Hoshino A, Zheng HD, Morley M, Arany Z, Rabinowitz JD. NADPH production by the oxidative pentose-phosphate pathway supports folate metabolism. Nat Metab. 2019 Mar;1:404-415.
2. Zhang Y, Xu Y, Lu W, Ghergurovich JM, Guo L, Blair IA, Rabinowitz JD, Yang X. Upregulation of Antioxidant Capacity and Nucleotide Precursor Availability Suffices for Oncogenic Transformation. Cell Metab. 2021 Jan 5;33(1):94-109.e8.
3. Ryan K, Tekwani BL. Current investigations on clinical pharmacology and therapeutics of Glucose-6-phosphate dehydrogenase deficiency. Pharmacol Ther. 2020 Dec 14;222:107788.
4. Zhong B, Jiang D, Hong Y, Li L, Qiu L, Yang R, Jin X, Song Y, Chen C, Li B. Glucose-6-phosphate dehydrogenase neutralizes stresses by supporting reductive glutamine metabolism and AMPK activation.Signal Transduct Target Ther. 2021 Feb 4;6(1):46.
5. Liu M, Wang Y, Yang C, Ruan Y, Bai C, Chu Q, Cui Y, Chen C, Ying G, Li B. Inhibiting both proline biosynthesis and lipogenesis synergistically suppresses tumor growth. J Exp Med. 2020 Mar 2;217(3):e20191226.
6. Wang Y, Bai C, Ruan Y, Liu M, Chu Q, Qiu L, Yang C, Li B. Coordinative metabolism of glutamine carbon and nitrogen in proliferating cancer cells under hypoxia. Nat Commun. 2019 Jan 14;10(1):201.
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






