化学基本试剂(化学试剂基础汇总)
一、化学试剂的分类
我国的试剂规格基本上按纯度划分,共有优级纯、分析纯、化学纯、高纯、光谱纯、基准和分光纯等7种。
(1)优级纯(GR),99.8%,这种试剂纯度最高,杂质含量最低,适合于重要精密的分析工作和科学研究工作,使用深绿色瓶签。
(2)分析纯(AR),99.7%,略次于优级纯,适合于重要分析及一般研究工作,使用金标红瓶签
(3)化学纯 (CP),≥99.5%,纯度与分析纯相差较大,适用于工矿,学校一般分析工作。使用中蓝标签。
(4)实验试剂(LR)
(5)基准试剂(PT),专门作为基准物使用,可直接配制标准溶液。
(6)光谱纯试剂(SP),表示光谱纯净。但由于有机物在光谱上显示不出,所以有时主要成分达不到99.9%以上,使用时必须注意,特别是作为基准物时,必须进行标定。
(7)高纯试剂(EP),纯度远高于优级纯的试剂叫做高纯试剂(大于等于99.99%)

二、试剂的管理
(一)化学试剂的使用管理制度
实验室首先应该有一套完整的请购、审批、采购、验收、入库、领用制度。要特别注意采购时要有正规进货渠道的正规试剂店购买,按照国家标准和化工部行业标准生产的试剂。危险物品的采购和提运按公安部门和交通运输部门的有关规定办理。在之后的保存与使用中,应健全严格的保管制度与领用制度。
1、所有试剂必须有明显标签,应注有名称、类别、产品标准、含量、规格、生产厂家、出厂批号等,有的试剂还应标明保质期。对字迹不清的标签要及时更换。无标签或标签无法辨认的试剂都要当成危险物品重新鉴别后小心处理,不可随便乱扔,以免引起严重后果。
2、按照试剂的种类、规格分别储存保管,对于不常用的试剂,管理人员要定时检查,以保证试剂包装完好、标签完整、字迹清楚。
3、化学试剂盛装容器应封闭,防止漏气、潮解,见光容易起变化的化学试剂应包装在深色的玻璃容器或避光的容器里,对化学试剂的包装和质量要定期检查。
4、化学试剂储存室周围及内部严禁火源;实验室的火源要远离易燃、易爆物品,有火源时,不能离人。
5、易燃易爆试剂应避光、防火和防电等,储存于铁柜中,柜子的顶部都有通风口。要确定合理的储存量,不许过量,且包装容器应密封性好。
6、遇水能分解或燃烧、爆炸的化学试剂、钾、钠、三氯化磷、五氯化磷、发烟硫酸等不准与水接触,不准放置与超市的地方储存。
7.经常检查危险化学品,防止因变质、分解造成自燃、自爆事故。对剧毒物品的容器、变质料、废渣及废水等应予妥善处理。
8.不外借化学试剂,特殊需要借化学试剂时,必须经领导批准签字。
9.取用化学试剂的器皿必须分开,每种试剂用一件器皿,不得混用。
10.使用有机溶剂和挥发性强的试剂的操作,应在通风良好的地方或在通风橱内进行。任何情况下,都不允许用明火直接加热有机溶剂。
11.凡使用强酸强碱等化学试剂时,应按规定要求操作和贮存。
二)危险试剂的分类及管理
化学实验室用到的危险试剂主要包括剧毒品、强腐蚀品和易燃易爆品三大类,下面就危险试剂的分类和管理进行分别阐述:
1. 剧毒品
按照国标GB 6944的规定,实验室用到的毒品有:汞盐、铬盐、铅盐、砷化合物、亚硝酸盐化合物、多环芳香烃及其衍生物、含氯含磷有机物等。
毒品(特别是剧毒品)按照规定应该分柜存放、严格管理、定期清查盘点、严禁外流。其中,某些剧毒品物质,如配位滴定中使用的氰化物,应按规定严格执行“五双制度”,即双人保管、双人收发、双人领用、双本帐、双锁管理。
放毒品的试剂室应通风良好,防止挥发和分解出的毒气在室内积聚;盛放毒品的试剂瓶要密封良好,移动时轻拿轻放,以杜绝人与毒品的接触。
2. 强腐蚀品
实验室用到的强腐蚀品主要有浓硫酸、氢氟酸、液氯、液溴等物质。这类物资搬运时应轻取轻放,严禁撞击、摔碰和强烈振动,严禁肩扛背负。
强腐蚀品一定要放置在牢固的试剂柜内,不要放在顶层或内层等取用困难的位置。和其它危险品一样,强腐蚀品也要确保安全管理、安全取用、杜绝外流。
3. 易燃易爆品
实验室用到的易燃易爆品种类繁多。许多易燃液体闪点低、易着火、挥发性大、粘度小、密度低、易扩散,它们作为有机溶剂使用时,其蒸气与空气混合到一定比例时可形成气态爆炸物,这种混合气遇到明火,静电或电火花时,可导致爆炸,因此实验室常把易燃液体作为防火防爆的防范重点。
实验室用到的石油醚、汽油等是最易燃液体,这些物质与一些强氧化剂(如硝酸盐、高锰酸钾、氯酸钾等)接触,遇有摩擦、碰撞等就能爆炸,一定要注意防范。
固体易燃物包括白磷、金属钾、钠、镁、铝粉、硫磺以及众多的无机、有机类化合物,其中有些物质有自燃性,许多物质对热、摩擦、碰撞极为敏感,大多数易燃物的燃烧会释放出有毒气体。
实验室管理人员要熟悉这类试剂的性质和购置、使用、保管知识,做好安全消防准备工作,常抓不懈,提高警惕,杜绝重大事故的发生隐患。
三、化学试剂的变质分析及保质期
配好的试剂,在保存的过程中,或多或少会出现一些问题。因此,了解试剂常见的一些可能变质的现象,有助于我们掌握一般规律,并能顺利解决实验中出现的问题。一般而言,除少数不影响使用的现象外,试剂变质都得重新配制。
1. 物理性质的变化
最常见的有:产生沉淀或结晶、产生絮状物、颜色变化、黏度变化、产生霉菌、产生气味。
产生沉淀或结晶:最常见的是一些缓冲液,当温度比较低的时候,可能有些物质是饱和溶液,低温可使其析出。当恢复至室温时,即溶解。
产生絮状物:有些物质在低温下析出成絮状,一般不影响使用。但要仔细观察,如絮状物是其它物质,或者是菌丝,则不可用。
产生颜色变化:这一变化可能是在配制过程中加温后,过一段时间出现的;也有可能是贮存过程中受光照所引起的;也有可能是溶液中各物质相互作用所引起的。一般是颜色变深。
产生黏度变化:主要是一些高分子物质的“溶液”。其实高分子是分散在其中,不是真正的溶解。如:明胶溶液,配制时间过长,有的就会变稀,这可能是明胶的质量问题。
产生霉菌:常见于含水的,含糖分较高的一些溶液。主要是保存不当所致。一般而言,配制过程中注意操作,配好后置冷藏,短时间内是不会出现霉菌的。
产生气味:这主要是可能溶液中的物质相互反应产生了一些气体,或者本身溶解导致其中的气体跑了出来,也有的是本身固有的气味变化,如:产生氨气气味、失去醋酸气味等。
2. 化学性质的变化
比如:pH的变化、失去氧化性、失去还原性
pH的变化:当怀疑试剂出现问题的时候,我们可以测一下其pH。如不在正常范围内,即可认为已变质。
失去氧化性:比如浓硫酸取一滴滴于报纸上,没有像往常一样将报纸碳化,可判断此硫酸已不可用。这可以说是通过简单的观察来判断试剂有无变质。同样,像双氧水等一些强氧化剂可通过类似的检测来判断。
失去还原性:像维生素C 等还原性物质,当变质时一般有颜色变化。
3.生物学性质的变化
比如:酶失活、生物分子降解等
这种变化并不是一下就可以看出来的。往往是做实验中,或者是实验做完后结果不理想时,才会考虑可能是试剂出了问题。
常用化学试剂的有效期多久?延长有效期的方法有哪些?我们往期文章已汇总,可点击这里查看。
四、化学试剂的配制方法
(一)化学试剂的配制流程
1. 计算;
2. 称量;
3. 溶解;
4. 转移;
5. 定容;
6. 混匀;
7. 装瓶;
8. 贴标签。
(二)化学试剂的计算
质量分数计算
定义:100克溶液(溶剂 溶质)中含有的溶质克数,单位:% 或g/100g
计算公式:质量分数=(溶质质量/溶剂质量 溶质质量)X100%
注意:一般不做特殊说明的百分含量,就是指质量分数
质量摩尔浓度计算
定义:溶液中某溶质的物质的量除以溶剂的质量,称为该溶质的质量摩尔浓度。
计算公式:质量摩尔浓度=溶质摩尔数/溶剂质量 单位mol/Kg
注意:质量摩尔浓度与物质的量浓度相比,前者不随温度变化,在要求精确浓度时,必须用质量摩尔浓度表示。但对于一般稀溶液来说,其密度近似等于水密度,可以近似认为c(mol/L)=b(mol/kg)
质量比浓度
定义:指两种固体试剂相互混合的表示方法
示例:
(1)钙指示剂在水溶液中不稳定,也容易变质,不适合于配成水溶液,所以通常是与干燥的NaCl混合后直接将固体加入待测溶液中使用。
1%钙指示剂(1 100):1g钙指示剂加100g氯化钠
体积分数(体积百分浓度)
定义:100ml溶液中所含溶质的体积数,一般用来表示溶质为液体的溶液,如乙醇(95%)溶液。常用于酒类样品的酒精度含量。
物质的量浓度计算
定义:单位体积溶液中所含溶质B的物质的量,符号为C,单位:mol/L。
计算公式:
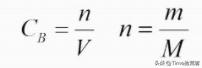
摩尔质量: M,单位g/mol, 在数值上等于该物质的相对原子质量或相对分子质量。
体积比浓度
定义:指用溶质与溶剂的体积比表示的浓度。
示例:
(1)1盐酸,即表示1体积量的盐酸和1体积量的水混合的溶液。
(2)H2SO4(1 4)即表示此种硫酸水溶液是由1体积的浓硫酸(相对密度1.84)与4体积的水混合而成。
注意:体积比浓度只在对浓度要求不太精确时使用。
质量体积浓度
定义:用1L溶液里所含溶质的克数来表示的溶液浓度,单位: g/L、mg/L。
示例:
(1)配制100g/L氢氧化钠溶液
称取l00g氢氧化钠,用少量水溶解后,稀释至1L。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com