聚芳砜非等温降解动力学(砜过不硫)
1,4-二羰基化合物是当代有机合成和化学工业中非常重要的合成子,2,3-取代1,4-二羰基结构单元广泛存在于天然产物、药物和生物活性分子中(图1A)。相比于发展成熟的手性1,3-或1,5-二羰基化合物的制备方法,手性1,4-二羰基化合物,尤其是2,3位碳具有手性的1,4-二羰基化合物的合成仍十分具有挑战性。目前,在合成该类化合物的众多方法中,最常用的是通过氧化偶联或基于烯醇烷基化反应的极性反转策略来直接构建1,4-二羰基化合物的C2-C3键(图1B)。这两种方法都以两种羰基化合物为原料,同时需在底物中引入手性基团,前者尚无法控制产物的立体构型(非对映和对映选择性),后者仅能将产物的相对构型(非对映选择性)控制在中等水平,并且存在着底物范围窄、合成繁琐、官能团兼容性差等诸多不足。因此,发展一种行之有效的方法实现2,3-碳手性1,4-二羰基化合物的立体选择性合成具有十分重要的理论意义和实际应用价值。

图1. 2,3位碳具有手性的1,4-二羰基化合物的制备。图片来源:Science
近日,奥地利维也纳大学的Nuno Maulide教授(点击查看介绍)课题组通过一种可扩大规模、具有普适性的方法——硫鎓加速的[3,3]-σ重排策略,高效实现了2,3-取代线性1,4-二羰基化合物的立体多样性合成。他们以商业化的手性亚砜为原料,通过两步反应制备了手性亚砜烯烃衍生物(图2C),该试剂与炔酰胺在Brønsted酸的催化下生成硫鎓-氧原子修饰的1,5-二烯中间体,然后经立体专一的[3,3]-σ重排反应形成1,4-羰基-硫羰基正离子中间体,最后水解脱硫得到相应的1,4-二羰基产物(图2D)。该方法不仅可以高非对映、对映选择性地合成各种2,3位具有两个连续手性碳中心的1,4-二羰基类化合物,还能应用于一系列药物和天然产物中间体的制备。相关成果发表在Science 杂志上。

图2. 硫鎓加速[3,3]-σ重排策略实现1,4-二羰基化合物的立体多样性合成。图片来源:Science

亚砜类化合物具有棱锥形结构,与其他手性基团相比,至少存在三个具有明显位阻和电性差异的配基—孤对电子、氧原子和两个烷基、烯基或芳基取代基。当R1与R2不同时,亚砜具有光学活性。大多数亚砜(除烯丙基、苄基亚砜)的热力学常数计算表明,亚砜的两个对映异构体在200 ℃的高温下才能相互转化,借助显著的光学稳定性,亚砜类化合物作为手性诱导辅助试剂在不对称合成中有着广泛的应用。此外,S-O键的极化使O原子带负电荷,O原子具有一定的亲核性,并能参与加成、取代等反应形成硫鎓离子中间体,继而诱导不对称重排反应发生。例如,早在上世纪80年代初期,美国密歇根大学的J. P. Marina教授等人就使用手性烯基亚砜与二氯代烯酮进行加成反应,生成硫鎓-氧原子修饰的1,5-二烯,随后发生立体专一的[3,3]-σ重排反应,得到1,4-羰基-硫羰基正离子中间体,硫羰基最后接受分子内亲核基团进攻生成光学活性的五元环内酯产物(图3, J. Am. Chem. Soc., 1981, 103, 7689)。尽管该过程中硫的手性可以很好地转移到碳中心手性上,但是该反应只适用于特定的底物,而且需要使用高活性的烯酮试剂。

图3. 手性烯基亚砜参与硫鎓加速的不对称[3,3]-σ重排反应。图片来源:Top. Curr. Chem., 2007, 275, 103

图4. Maulide课题组近期研究。图片来源:The Maulide Group
Nuno Maulide教授课题组长期致力于炔酰胺、亚砜、锍叶立德等试剂诱导活性中间体的重排反应、Domino反应及不对称反应的研究(图4)。2017年,该课题组发展了一种手性芳基亚砜与炔酰胺参与的不对称重排反应(图5)。反应过程中,亚砜首先选择性地加成到由炔酰胺在Brønsted酸作用下形成的烯亚胺中间体,随后发生立体专一的硫鎓促进[3,3]-σ重排反应,最终可得到一系列高光学活性的炔烃羰基化-芳基化的产物。


图5. 手性芳基亚砜参与硫鎓加速的不对称[3,3]-σ重排反应。图片来源:Angew. Chem. Int. Ed., 2014, 53, 8718; Angew. Chem. Int. Ed., 2017, 56, 2212
从前期的工作可以看出,由亚砜引发的硫鎓[3,3]-σ重排反应会生成一类1,4-羰基-硫羰基中间体,在多数情况下,该中间体完成后续反应后会将硫原子保留在产物分子中。基于此,Maulide教授等人希望利用手性烯基亚砜与炔酰胺反应生成1,4-羰基-硫羰基中间体,并最终通过水解脱硫得到光学活性的1,4-二羰基化合物。经过系统的反应条件筛选,他们发现加入适量的水和使用噁唑烷酮修饰的炔酰胺能够得到最佳的反应结果。
在温和的反应条件下,作者考察了底物的适用范围(图7和图8)。反应具有广泛的官能团兼容性,可以高非对映选择性和对映选择性地合成一系列具有叔碳甚至季碳中心的1,4-二羰基化合物。产物的2,3位碳上取代基团可以为芳基、烷基、-CF3、F原子,并可兼容一系列对碱敏感的官能团,如酯基、氰基、酰亚胺、酮羰基、醛基、炔基和烷基氯等。
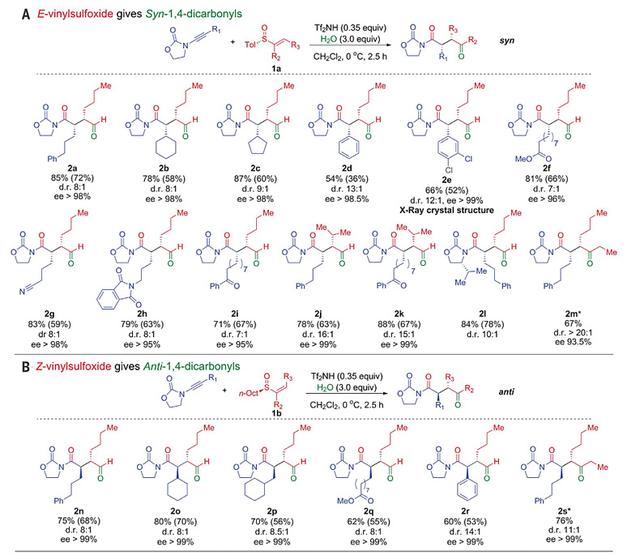
图6. 具有手性叔碳中心的顺/反1,4-二羰基化合物的合成。图片来源:Science

图7. 具有手性季碳中心的1,4-二羰基化合物的合成。图片来源:Science
从具有不同烯烃构型(Z/E)和不同硫手性(R/S)的亚砜出发,他们可以高效合成1,4-二羰基化合物的全部四种立体异构体。机理研究表明,硫鎓促进的[3,3]-σ重排反应的过渡态采用椅式构象,亚砜的硫手性诱导决定产物的绝对构型(对映选择性),亚砜的烯烃构型决定产物的相对构型(非对映选择性/顺反选择性)。其中,高对映选择性合成顺式产物(syn)需要使用芳基-E-烯基亚砜,而高对映选择性合成反式产物(anti)则需要使用烷基-Z-烯基亚砜(图9)。

图8. 影响1,4-二羰基化合物相对构型和绝对构型的决定因素。图片来源:Science
此外,通过以上方法合成的多取代手性1,4-二羰基化合物还可进一步转化为一系列药物和天然产物中间体,如重要的琥珀酸类合成砌块、基质金属蛋白酶(MMP)抑制剂等(图10)。
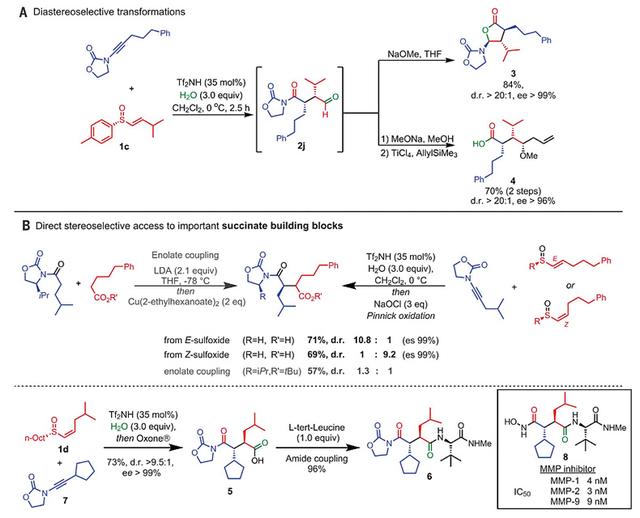
图9. 多取代手性1,4-二羰基化合物的转化。图片来源:Science
总结
Maulide教授等人使用手性亚砜导向硫鎓促进的[3,3]-σ重排策略,简便高效地合成了一系列光学活性的1,4-二羰基化合物,通过控制亚砜中硫原子和烯烃的立体构型,可以实现2,3位取代1,4-二羰基化合物所有立体异构体的高效合成。非常有趣的是,反应中起决定性作用的硫原子并未出现在产物分子中。该方法极大推动了手性1,4-二羰基化学的发展,在药物合成及化学、化工等领域有着广阔的应用空间。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






