pcr产物纯化和胶回收的区别(PCR产物的胶回收分离纯化)
一、实验仪器
1、琼脂糖凝胶电泳系统
2、紫外观察分析仪
3、离心机
4、单面刀片
5、恒温水浴锅
二、试剂
1、 DNA回收试剂盒
2、50×TAE
3、ddH2O
三、步骤
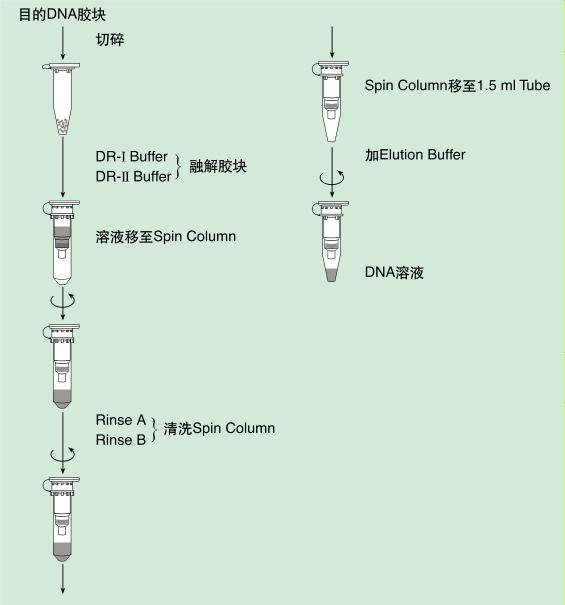
1 在紫外灯下切分含DNA的琼脂糖块,尽可能除去多余的琼脂糖.放入1.5ml离心管中。
4. 称量胶块重量,计算胶块体积。计算胶块体积时,以 1 mg=1 μl 进行计算。
5. 向胶块中加入胶块融化液 DR-I Buffer,DR-I Buffer 的加量如下表:
凝胶浓度 DR-I Buffer 使用量
1.0% 3 个凝胶体积量
1.0%~1.5% 4 个凝胶体积量
1.5%~2.0% 5 个凝胶体积量
6. 均匀混合后 75℃加热融化胶块(低熔点琼脂糖凝胶只需在 45℃加热)。此时应间断振荡混合,使胶块充分融化(约 6~10 分钟)。注)胶块一定要充分融化,否则将会严重影响 DNA 的 回收率。
7. 向上述胶块融化液中加入DR-I Buffer量的1/2体积量的 DR-II Buffer,均匀混合。当分离小于 400 bp 的 DNA 片段时,应在此溶液中再加入终浓度为 20% 的异丙醇。
8. 将试剂盒中的 Spin Column 安置于 Collection Tube 上。
9. 将上述操作 7 的溶液转移至 Spin Column 中,12,000 rpm 离心 1 分钟,弃滤液。 注)如将滤液再加入 Spin Column 中离心一次,可以 提高 DNA 的回收率。
10. 将500 μl的漂洗液Rinse A加入Spin Column中,12,000 rpm 离心 30 秒钟,弃滤液。
11. 将700 μl的Rinse B加入Spin Column中,12,000 rpm 离心 30 秒钟,弃滤液。注)请确认Rinse B中已经加入了指定体积的100%乙醇。
12. 重复操作步骤 11。
13. 将 Spin Column 安置于新的 1.5 ml 的离心管上,在 Spin Column 膜的中央处加入 25 μl 的灭菌蒸馏水或 Elution Buffer,室温静置 1 分钟。注)把灭菌蒸馏水或 Elution Buffer 加热至 60℃使用时有利于提高洗脱效率。
14. 12,000 rpm 离心 1 分钟洗脱 DNA。将1.5ml离心管(DNA)贮存于-20℃。
15 琼脂糖凝胶电泳检测回收产物。
制备 :溶胶液:6 M NaClO 4 (pH 5.2) ,0.03M NaAC(pH 5.2)溴酚红少许
洗液:50 mM Tris-cl,0.1 mM EDTA,pH 8.0) 70%乙醇
存储液:TE buffer (10 mM Tris-cl,0.1 mM EDTA,pH 8.0).
注意事项
1. 电泳的buffer和gel都是新制的,切胶的台子清理干净,刀片最好洗净灭菌,总之一句话就是保证切下的带没有外源dna污染。
2. 切胶是要把整个目的片断所在位置的胶全部回收。为了减少胶的体积,可以用相对比较薄的胶来做,只要够点样即可,也可采用薄而宽的梳子来跑胶。
3. 关于防护,在一般有机玻璃后就足够了,戴上防护面具以保护眼睛,如果戴树脂眼镜就可以了。要是非常害怕紫外照射,或者对于胶有特殊要求,例如要求不含EB,可以采用点marker和带刻度的尺子一起照相的方法来确定目的条带在胶上的位置进行切胶。
4. 按照正常程序点marker跑胶,然后切下有marker的胶,EB染色,紫外灯下与带刻度的尺子一起照相。由于要回收的带与marker间的相对位置已知,根据尺子来衡量未染色胶上目的带的位置即可。如果觉得很难判断,可以直接在marker边点少量的样,这样位置就容易确定了。
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






