高考化学工艺流程题模板(工艺流程专项复习系列)

专项6-氛围、溶剂、压强控制
一.氛围控制
依据产品质量要求以及反应物的“个性”,工业实践中需将化学反应置于某种氛围中进行,常见的有:
①隔绝空气:主要是防止还原性物质被空气中的O2氧化;
②在空气中:空气是廉价的原料,借助其中的成分尤其是氧气参与化学反应;
③通入稀有气体:考虑防止物质被氧化、潮解等。
【练习1】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量碳及二氧化硅)为原料制备的流程如下:

酸浸时,通入O2的目的是_____________,该反应的离子方程式为____________________________________。
【答案】将FeSO4氧化为Fe2(SO4)3 4Fe2 O2 4H ==4Fe3 2H2O
【解析】酸浸时有亚铁离子生成,通入氧气能将亚铁离子氧化为铁离子;反应的离子方程式为4Fe2 O2 4H ==4Fe3 2H2O,故答案为:将FeSO4氧化为Fe2(SO4)3;4Fe2 O2 4H ==4Fe3 2H2O;
【练习2】我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:

氧化除杂工序中ZnO的作用是_____________,若不通入氧气,其后果是_____________________________。
【答案】调节溶液的pH 无法除去杂质Fe2+
【解析】由金属离子形成氢氧化物沉淀的pH可知,需要将Fe2 转化为Fe3 ,生成Fe(OH)3沉淀除去,故加入ZnO与溶液中的H 反应,调节溶液pH来沉淀Fe3 ;若不通入氧气,则无法将Fe2 转化为Fe3 ,完全沉淀Fe2 时Zn2 也会被沉淀。故答案是调节溶液的pH;无法除去杂质Fe2+;
【练习3】目前世界上60%的镁是从海水中提取的,从海水中提取的MgCl2制得Mg和Cl2,进一步联合用金红石(主要成分TiO2)冶炼金属钛,工业上其主要的生产流程如下:

工业上冶炼金属钛的上述生产流程,其第2步是在稀有气体氛围和加热的条件下,用镁与TiCl4反应得到钛,写出这步反应的化学方程式____________________,该反应时稀有气体氛围的作用是_____________________________________,该反应的金属冶炼方法属于是____________________。
【答案】 TiCl4 2Mg

【解析】在稀有气体氛围保护下,镁与TiCl4反应得到钛和氯化镁,反应的化学方程式为:TiCl4 2Mg


【练习4】CuCl2常用于颜料、木材防腐等工业,并用作消毒剂、媒染剂、催化剂。工业上用粗制的氧化铜粉末(含杂质FeO和SiO2)来制取无水CuCl2的流程如下:

第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、 。需要在氯化氢气流中蒸干制取无水氯化铜的原因是 。
【答案】酒精灯、蒸发皿、玻璃棒;氯化氢可抑制CuCl2的水解
【解析】第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、酒精灯、蒸发皿、玻璃棒。由于氯化铜在溶液中水解生成氢氧化铜和氯化氢,所以需要在氯化氢气流中蒸干制取无水氯化铜的原因是氯化氢可抑制CuCl2的水解。
【练习5】某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:

反应2Mg TiCl4

【答案】Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化
【解析】Mg和Ti都有强还原性,在高温条件易空气中氧气被氧化,而在Ar气氛中可以防止被氧化。
【练习6】金属镉广泛用于合金制造及电池生产等,一种用铜镉废渣(含Cd、Zn、Cu、Fe及Co等单质)制取海绵镉的工艺流程如下:
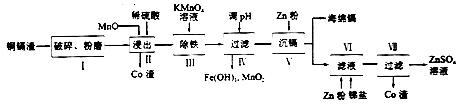
(1)步骤Ⅰ进行破碎和粉磨的目的是_________________________________。
(2)步骤Ⅱ需隔绝O2的原因________________________________(用文字和方程式说明)。
【答案】(1)提高原料浸取率和浸取时反应速率
(2)防止发生2Cu 4H O2 =2Cu2 2H2O,导致铜被浸出
【解析】(1)步骤Ⅰ进行破碎和粉磨目的是增大接触面积,提高原料浸取率和浸取时反应速率。
(2)为防止2Cu 4H O2 =2Cu2 2H2O发生,导致铜被浸出,所以步骤Ⅱ需隔绝O2。
【练习7】石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯与综合利用工艺如下:

(注:SiCl4的沸点为57.6 ℃,金属氯化物的沸点均高于150 ℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是__________________________________。
【答案】排出装置中的空气
【解析】向反应器中通入Cl2前,需通一段时间N2,主要目的是排出装置中的空气
二.溶剂控制
许多无机化学反应是在水溶液中进行的,也有一些反应需加人某种有机溶剂以改变某些性状。无机反应中,选择溶剂主要考虑物质在溶剂中的溶解性和溶剂的挥发性。
水可能带来的隐患:溶解、水解
所选溶剂可能带来的好处:比如用乙醇代替水对产品进行洗涤,不但可以减少溶解,还易于晾干。
【练习1】铝铁合金可在某些航天器件中替代钛铝合金,大幅度降低成本。如下实验流程可利用废弃的钛铝合金制备聚合硫酸铁和明矾:

②浓缩时向其中加入一定量的乙醇,加入乙醇的目的是 。
【答案】②降低聚合硫酸铁的溶解度,以便析出;所得产物易于干燥
【解析】②Fe与稀H2SO4反应生成FeSO4,而聚合硫酸铁中的Fe为 3价,所以需要用氧化剂H2O2将Fe2 氧化产生Fe3 。为促使Fe3 水解,加入Y可调节pH,为不引入杂质,Y 应为Fe2O3或Fe(OH)3。在溶液中浓缩时加入乙醇,可以降低聚合硫酸铁的溶解度,便于其析出,另外乙醇易挥发,产品易干燥。
【练习2】工业废铁屑(含有一些不溶于酸的杂质)为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,其主要流程如下:

工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是______ ______;
【答案】降低K2SO4的溶解度,有利于K2SO4析出
【解析】因K2SO4在醇中的溶解度小,工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,这样可降低K2SO4的溶解度,有利于K2SO4析出。
【练习3】1871年门捷列夫最早预言了类硅元素锗,锗元素在元素周期表中与硅元素同族,并位于硅的下一周期。1886年德国化学家温克勒发现和分离了锗元素,并以其祖国的名字命名为“Ge”。锗是重要的的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。
已知:①丹宁是一种有机沉淀剂,可与四价锗络合形成沉淀:②GeCl4易水解,在浓盐酸中溶解度低。

步骤④不选用稀盐酸,而选用浓盐酸的原因可能是__ ________、____ ____(写出两点)。
【答案】防止四价锗水解 防止GeO2不能充分反应,有利于GeCl4析出
【解析】由于GeCl4易水解,在浓盐酸中溶解度低,所以用浓盐酸溶解GeO2,同时可防止四价锗水解,防止GeO2不能充分反应,有利于GeCl4析出,故答案为:防止四价锗水解,防止GeO2不能充分反应,有利于GeCl4析出。
【练习4】在碱性环境下制取CaO2·8H2O的装置如图所示,
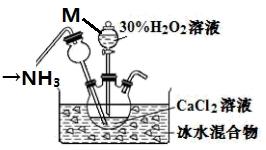
③将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤。用蒸馏水洗涤的操作是____________________________,使用乙醇洗涤的目的是_____________________。
【答案】沿玻璃棒向过滤器中加水,浸没沉淀,静置,待水流尽,重复此操作2~3次 减少产品的损失,便于干燥产品
【解析】③蒸馏水洗涤沉淀的操作为:沿玻璃棒向过滤器中加水,浸没沉淀,静置,待水流尽,重复此操作2~3次;使用乙醇洗涤的目的是减少产品的溶解损失,同时由于乙醇易挥发,便于后续干燥产品,故此处填:减少产品的损失,便于干燥产品。
【练习5】实验室用如图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.

已知:K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定.(制备KClO及K2FeO4)
(3)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L 溶液中,
② ,
③ ,
④搅拌、静置、过滤,用乙醇洗涤2~3次,用乙醇洗涤的理由_____ ________ 。
⑤在真空干燥箱中干燥.
(测定产品纯度)
【答案】①KOH ②过滤 ③将滤液置于冰水浴中,向滤液中加入饱和KOH溶液
④K2FeO4易溶于水,防止用水洗涤时晶体损失
【解析】K2FeO4易溶于水、微溶于浓KOH溶液,所以提纯K2FeO4粗产品时可以①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,②过滤,③将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,④搅拌、静置、过滤,因K2FeO4易溶于水,防止用水洗涤时晶体溶解会损失,改用乙醇洗涤2~3次,⑤在真空干燥箱中干燥。
三.压强控制
对于有气体参加的化学反应,增加气体的分压可提高化学反应速率在一定时间段内提高较贵重原料的转化率。
【练习1】碲被誉为“现代工业、国防与尖端技术的维生素”,工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属其工艺流程如下:

已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是_____________________________________,其中“加压”的目的是_________________________________。写出“加压酸浸1”过程中Cu2Te发生反应的化学方程式_______________________________。
【答案】溶液酸性过强,TeO2会继续与酸反应导致碲元素损失 增大O2浓度,加快反应速率,提高浸出率 Cu2Te 2O2 2H2SO4

【解析】“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是;TeO2是两性氧化物,溶液酸性过强TeO2会继续与H2SO4反应而导致磅元素损失。“加压浸出”过程的离子方程式为:Cu2Te 2O2 4H+=2Cu2+ TeO2 2H2O;其中“加压”的目的是:增大O2浓度,加快反应速率,提高浸出率;“加压酸浸1”过程中Cu2Te发生反应的化学方程式为Cu2Te 2O2 2H2SO4

【练习2】聚合硫酸铁(PFS)是水处理中重要的絮凝剂,如图是以回收废铁屑为原料制备PFS的一种工艺流程.

相对于常压蒸发,减压蒸发的优点是_______________________________________________。
【答案】可以防止温度过高,聚合硫酸铁分解
【解析】减压蒸发可以防止温度过高,导致产物分解。
【练习3】亚氯酸钠(NaClO2)是一种重要的杀菌消毒剂。以氯酸钠(NaC1O3)为原料 制备NaC1O2粗品的工艺流程如下图所示。

己知:①纯C1O2易分解爆炸,空气中C1O2的体积分数在10%以下比较安全。②NaClO2高于60°C会分解。
蒸发时,需要减压的目的是_________________________________。
【答案】防止温度过高NaClO2分解
【解析】由题意可知,NaClO2高于60°C会分解,则蒸发时,需要减压防止温度过高NaClO2分解,故答案为:防止温度过高NaClO2分解。
【练习4】七水硫酸锌别名皓矾,常用作媒染剂、收敛剂、木材防腐剂,在医药上用于催吐剂。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的流程如下:

取28.70gZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示:

①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是___________________________。
②680℃时所得固体的化学式为____________________。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
【答案】①降低烘干的温度,防止ZnSO4·7H2O分解 ②b
【解析】①由于ZnSO4·7H2O易分解,烘干时要适当降低温度;
②n(ZnSO4·7H2O)=

免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






