化学酸碱盐经典题解答及分析(化学期末考试考点合集)
第十单元 酸和碱
一、酸、碱、盐的组成
酸是由氢离子和酸根组成的化合物。如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)。
碱是由金属离子和氢氧根组成的化合物。如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)。
盐是由金属离子(或铵根)和酸根组成的化合物。如:氯化钠、碳酸钠。
酸、碱、盐水溶液可以导电的原因:溶于水时形成自由移动的阴、阳离子。
二、酸
1、浓盐酸、浓硫酸的性质、特性、用途:
浓盐酸:“纯净”无色液体;工业盐酸为黄色因含Fe3 ;有刺激性气味;易挥发性(敞口置于空气中,瓶口有白雾);
用途:①金属除锈 ②制造药物 ③人体中含有少量盐酸,助消化。
浓硫酸:无色粘稠、油状液体;吸水性;脱水性;强氧化性;腐蚀性;
用途:①金属除锈 ②浓硫酸作干燥剂 ③生产化肥、精炼石油。
2、酸的通性
具有通性的原因:酸电离时所生成的阳离子全部是H
(1)与酸碱指示剂的反应:
使紫色石蕊试液变红色;不能使无色酚酞试液变色

(NB化学实验-酸与指示剂的反应)
(2)金属 酸 → 盐 氢气
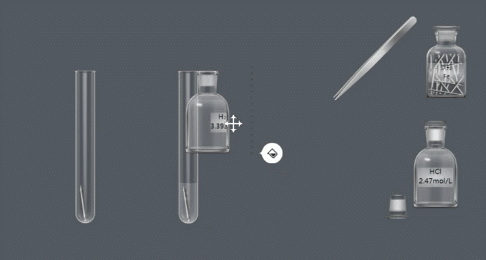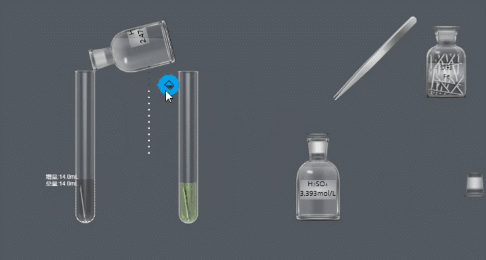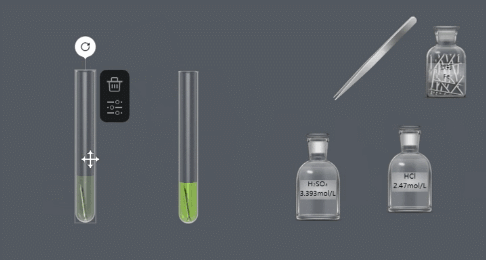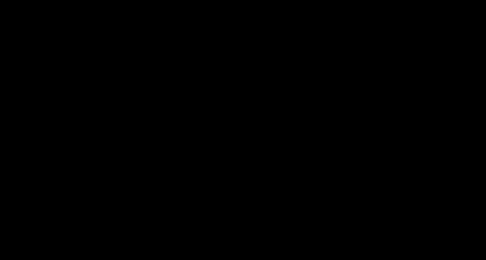
(NB化学实验-金属与酸的反应)
(3)金属氧化物 酸 → 盐 水

(NB化学实验-金属氧化物与酸的反应)
(4)碱 酸 → 盐 水

(NB化学实验-酸碱中和反应)
(5)盐 酸 → 另一种盐 另一种酸(产物符合复分解条件)

(NB化学实验-盐与酸的反应)
三、碱
1、氢氧化钠、氢氧化钙的物理性质、用途:
氢氧化钠:白色固体,极易溶于水,溶解放热,俗称:烧碱、火碱、苛性钠(具有强腐蚀性);
用途:
①氢氧化钠固体作干燥剂
②化工原料:制肥皂、造纸
③去除油污:炉具清洁剂中含氢氧化钠
制法:Ca(OH)2 Na2CO3== CaCO3↓ 2NaOH
氢氧化钙:白色粉末,微溶于水,俗称:熟石灰、消石灰;
用途:
①工业:制漂白粉
②农业:改良酸性土壤、配波尔多液
③建筑
制法:CaO H2O== Ca(OH)2
2、碱的通性
具有通性的原因:电离时所生成的阴离子全部是OH-
(1)碱溶液与酸碱指示剂的反应:
使紫色石蕊试液变蓝色,使无色酚酞试液变红色

(NB化学实验-碱与指示剂的反应)
(2)非金属氧化物 碱 → 盐 水
(3)酸 碱 → 盐 水:

(NB化学实验-酸碱中和反应)
(4)盐 碱 → 另一种盐 另一种碱
反应物均可溶,产物符合复分解条件

(NB化学实验-盐与碱的反应)
四、非金属氧化物与金属氧化物
1、非金属氧化物
(1)大多数可与水反应生成酸
CO2 H2O== H2CO3
SO2 H2O== H2SO3
SO3 H2O== H2SO4
(2)酸性氧化物 碱→ 盐 水
CO2 Ca(OH)2==CaCO3↓ H2O(不是复分解反应)
2、金属氧化物
(1)少数可与水反应生成碱
Na2O H2O== 2NaOH
K2O H2O== 2KOH
BaO H2O== Ba(OH)2
CaO H2O== Ca(OH)2
(2)碱性氧化物 酸→ 盐 水
Fe2O3 6HCl== 2FeCl3 3H2O
注:
难溶性碱受热易分解(不属于碱的通性)
如Cu(OH)2==CuO H2O(条件:加热)
2Fe(OH)3==Fe2O3 3H2O(条件:加热)
五、中和反应
1、定义:酸与碱作用生成盐和水的反应。
2、实质:OH- H == H2O。
3、应用:
(1)改变土壤的酸碱性。(2)处理工厂的废水。(3)用于医药。
4、溶液酸碱度的表示法——PH
(1) 0 ← 7 → 14
酸性增强 中性 碱性增强
(2)pH的测定:最简单的方法是使用pH试纸。
用玻璃棒(或滴管)蘸取待测试液少许,滴在PH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)。
(3)酸碱性与酸碱度关系:
指示剂 pH值 石蕊 酚酞
酸性 <7 变红色 无色
中性 =7 紫色 无色
碱性 >7 变蓝色 变红色
(4)酸雨:正常雨水的pH约为5.6(因为溶有CO2);pH<5.6的雨水为酸雨。
第十一单元 盐、化肥知识点
一、常见的盐
定义:能电离出金属离子(或NH4 )和酸根离子的化合物
1、氯化钠(NaCl)俗称:食盐,白色粉末,水溶液有咸味,溶解度受温度影响不大。
用途:(1)作调味品(2)作防腐剂 (3)消除积雪(降低雪的熔点)(4)农业上用NaCl溶液来选种(5)制生理盐水(0.9% NaCl溶液)Na 维持细胞内外的水分分布,促进细胞内外物质交换Cl- 促生盐酸、帮助消化,增进食欲。
2、碳酸钠(Na2CO3)俗称:纯碱(因水溶液呈碱性)苏打,白色粉末状固体,易溶于水。
用途:用于玻璃、造纸、纺织、洗涤、食品工业等。
3、碳酸氢钠(NaHCO3 )俗称:小苏打 白色晶体,易溶于水
用途:制糕点所用的发酵粉,医疗上治疗胃酸过多。
注:
① 粗盐中由于含有氯化镁、氯化钙等杂质,易吸收空气中的水分而潮解。
(无水氯化钙可用作干燥剂)
② 碳酸钠从溶液中析出时,会结合一定数目的水分子,化学式为Na2CO3·10H2O。
碳酸钠晶体Na2CO3·10H2O(纯净物),俗称天然碱、石碱、口碱。
风化:常温时在空气中放置一段时间后,失去结晶水而变成粉末。(化学变化)
③ 2NaHCO3==Na2CO3 H2O CO2↑(条件:加热)
NaHCO3 HCl==NaCl H2O CO2↑。
二、去除粗盐中不溶性杂质
1、实验步骤:溶解、过滤、蒸发.
① 溶解
实验仪器:烧杯、玻璃棒
玻璃棒的作用:加速溶解
② 过滤
实验仪器:铁架台(带铁圈)、漏斗、烧杯、玻璃棒
玻璃棒的作用:引流
③ 蒸发
实验仪器:铁架台(带铁圈)蒸发皿、酒精灯、玻璃棒
玻璃棒的作用:使液体受热均匀,防止液体飞溅
三、盐的化学性质
1、盐(可溶) 金属1 → 金属2 新盐
(金属1比金属2活泼,K、Ca、Na除外)
2、盐 酸 → 新盐 新酸
(满足复分解反应的条件)
3、盐 碱 → 新盐 新碱
(反应物需都可溶,且满足复分解反应的条件)
4、盐 盐 → 两种新盐
(反应物需都可溶,且满足复分解反应的条件)
注:
① 复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
② 常见沉淀:AgCl↓、BaSO4↓、Cu(OH)2↓、Fe(OH)3↓、Mg(OH)2↓、BaCO3↓、CaCO3↓;
生成气体:H 与CO32- 、NH4 与OH-
生成水:H 与OH-
③ 反应实质:
离子结合成:H2O:H 与OH-
生成气体:H 与CO32-;NH4 与OH-
生成沉淀:Ag 与Cl-、CO32- ,Ba2 与CO32-、SO42- ,Ca2 与CO32- ,Mg2 与OH-……
四、酸、碱、盐的溶解性
1、酸:大多数都可溶(除硅酸H2SiO3不溶)
2、碱:只有氨水、氢氧化钠、氢氧化钾、氢氧化钡和氢氧化钙可溶于水,其余均为沉淀
3、盐:钾盐、钠盐、硝酸盐、铵盐都可溶;
硫酸盐除BaSO4难溶,Ag2SO4、CaSO4微溶外,其余多数可溶;
氯化物除AgCl难溶外,其余多数均可溶;
碳酸盐除碳酸钾、碳酸钠、碳酸铵可溶,其余都难溶。
注:
BaSO4、、AgCl 不溶于水,也不溶于酸。
五、特殊离子鉴别:
1、氢离子H :
1、指示剂;2、活泼金属;3、金属氧化物;4、碱;5、某些盐:CO32-盐;
2、氢氧根离子OH-:
1、指示剂;2、某些盐:Fe3 、Cu2 盐;
3、氯离子Cl-:
用Ag NO3溶液,生成不溶于硝酸的AgCl沉淀;
4、硫酸根离子SO42-:
用Ba(NO3)2溶液,生成不溶于硝酸的 BaSO4沉淀;或用HCl和BaCl2;
5、碳酸根离子CO32-:
用HCl能产生使Ca (OH)2变浑浊的气体;
6、铁离子Fe3 :
用OH-能生成红褐色沉淀;
7、铜离子Cu2 :
用OH-能生成蓝色沉淀;
8、铵根离子NH4 :
用OH-能生成NH4OH,不稳定,分解出NH3;能使湿润的红色石蕊试纸变蓝;
9、镁离子Mg2 :
用OH- 能生成白色沉淀;
10、钙离子Ca2 :
用CO32- 能生成白色沉淀;
六、化学肥料
1、农家肥料:营养元素含量少,肥效慢而持久、价廉、能改良土壤结构。
2、化学肥料 (氮肥、钾肥、磷肥)
(1)氮肥作用:促进植物茎、叶生长茂盛、叶色浓绿(促苗)。
缺氮:叶黄。

① 常用氮肥:
NH4HCO3
含氮量:17.7%
使用注意事项:易分解,施用时深埋 铵态氮肥防晒防潮,且均不能与碱性物质(如草木灰、熟石灰等)混合施用;
NH4NO3
含氮量:35%
使用注意事项:易爆,结块不可用铁锤砸;
(NH4)2SO4
含氮量:21.2%
使用注意事项:长期使用会使土壤酸化、板结;
NH4Cl
含氮量:26.2%
使用注意事项:长期使用会使土壤酸化、板结;
CO(NH2)2
含氮量:46.7%
使用注意事项:含氮量最高的氮肥(有机物);
NH3· H2O
使用注意事项:加水稀释后施用,不稳定,易放出NH3↑、NaNO3。
② NH4 的检验
试剂:碱(NaOH、Ca(OH)2等)、湿润的红色石蕊试纸。
NH4NO3 NaOH=NaNO3 NH3↑ H2O
③ 生物固氮
豆科植物的根瘤菌将氮气转化为含氮的化合物而吸收。
(2)钾肥
作用:促使作物生长健壮、茎杆粗硬,抗倒伏(壮秆)。
缺钾:叶尖发黄。

常用钾肥:
① 草木灰:农村最常用钾肥(主要成分为K2CO3),呈碱性;
②K2SO4:长期使用会使土壤酸化、板结。
(3)磷肥
作用:促进植物根系发达,穗粒增多,饱满(催果)。
缺磷:生长迟缓,产量降低,根系不发达。

常用磷肥:
磷矿粉Ca3(PO4)2、钙镁磷肥(钙和镁的磷酸盐)、过磷酸钙 Ca(H2PO4)2和CaSO4。
不能与碱性物质混合施用。
重过磷酸钙 Ca(H2PO4)2 如草木灰、熟石灰。
(4)复合肥:
含N、P、K中的两种或三种
KNO3、NH4H2PO4、(NH4) 2HPO4。
不能与碱性物质混合施用
3、使用化肥、农药对环境的影响
(1)土壤污染:重金属元素、有毒有机物、放射性物质
(2)大气污染:N2O、NH3、H2S、 SO2
(3)引起水体污染 :N、P过多,导致水体富营养化,赤潮、水华等现象
4、合理使用化肥
(1)根据土壤情况和农作物种类选择化肥;
(2)农家肥和化肥合理配用。

●学会三大守恒,化学平衡难不倒你!
●干货|化学期末考试考点合集(二)!值得收藏!
●必须收藏!96个高考化学必考方程式
●干货|化学期末考试考点合集!值得收藏!
●干货|新课标主题2全解析——常见的无机物及其应用
●天啦噜!靠嗅觉竟然能预测暴雨?!?!
●干货|【电化学】专题复习知识点总结完整版
●味精到底致不致癌?!外国人为啥不吃味精?
●活动升级|邀请活动最多可获得7个月VIP!!

www.nobook.com
让教学更简单
长按扫码可关注
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






