crrt肝素抗凝治疗监测指标(重症COVID-19患者易发生凝血)

新的研究表明,新型冠状病毒肺炎(COVID-19)可能会导致高凝状态。北京协和医院严晓伟教授团队在武汉同济医院中法新城院区的援助工作中发现,COVID-19重症患者伴发了明显的凝血功能障碍和多发性脑梗死,且发现了抗磷脂抗体,该报告于近日发表在《新英格兰医学杂志》上。
医脉通编译整理,未经授权请勿转载。
病例报告
69岁男性,表现为发烧、咳嗽、呼吸困难、腹泻和头痛,既往有高血压、糖尿病和卒中病史。经核酸检测诊断为新冠病毒肺炎,起初给予支持治疗,后发展为低氧性呼吸衰竭,开始使用有创机械通气。
影像学检查显示毛玻璃样混浊和双侧肺浸润。CT检查发现,患者双下肢及左手食指和中指存在缺血迹象;脑部CT示双侧多个血管区域的梗死灶。表1总结了患者(患者1)在重症监护室的相关实验室结果,包括白细胞增多、血小板减少、凝血酶原时间和部分凝血活酶时间增加,及纤维蛋白原和D-二聚体的水平升高。随后的血清学检测显示,抗心磷脂IgA和抗β2-糖蛋白I IgA和IgG阳性。
表1 人口统计、临床特征以及实验室检查结果
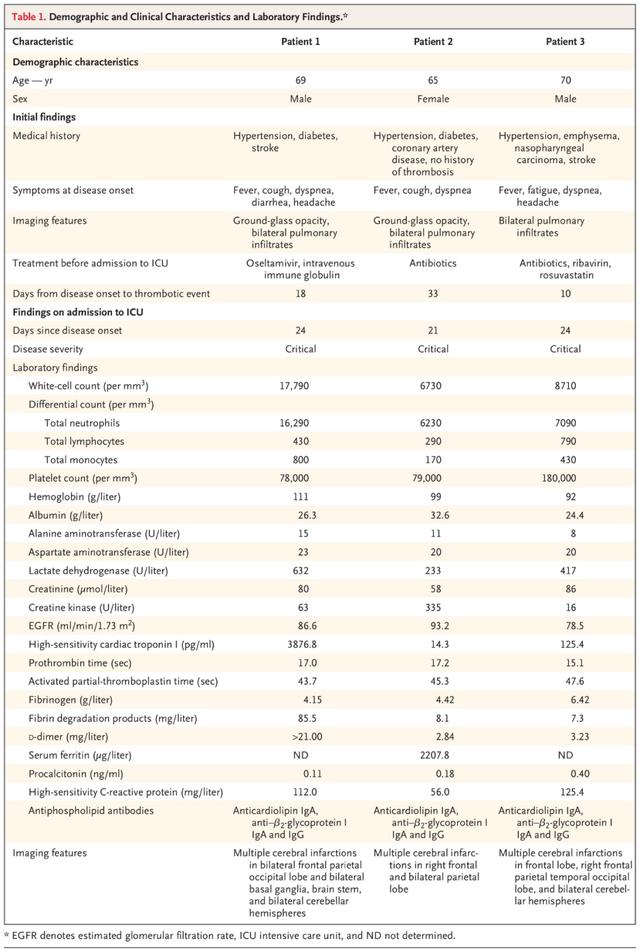
此外,在同济医院重症监护病房的另外两名新冠病毒肺炎患者中,也有类似发现。这些患者血清学检测也显示抗心磷脂IgA和抗β2-糖蛋白I IgA和IgG阳性(表1,患者2和患者3),但在所有患者中均未检测到狼疮性抗凝因子。
抗磷脂抗体的存在和异常靶向磷脂蛋白,对于抗磷脂综合征的诊断至关重要。但这些抗体也可以在患有严重疾病和各种感染的患者中短暂出现。抗磷脂抗体的存在可能很少导致血栓事件,但这些事件一旦发生,很难与危重患者多灶性血栓形成的其他原因相鉴别,如弥散性血管内凝血、肝素诱导的血小板减少和血栓形成性微血管病。
COVID-19与凝血问题
其实,早在COVID-19大流行初期,国内医生就已经注意到弥散性血管内凝血的问题。3月,由中国心血管协会和美国心脏病学会共同主办的网络研讨会公布了COVID-19患者尸体解剖结果,显示不仅肺部,包括心脏、肝脏和肾脏都有血栓。入院时D-二聚体的升高与武汉市COVID-19患者更高的住院死亡率相关。
来自北卡罗来纳大学的Stephan Moll博士表示,COVID-19与血栓形成密切相关,包括大血管血栓、深静脉血栓形成/肺栓塞,以及动脉事件或微血管血栓形成等。在美国,即使接受了预防性抗凝治疗,住院患者仍然经常会出现血栓形成。
Stephan Moll博士认为,即使患者没有既往血栓发生,也应考虑全剂量抗凝治疗,以防肺部或肾脏的微血管血栓形成导致肺衰竭、肾衰竭甚至死亡。但哥伦比亚大学欧文分校心脏导管实验室主任Ajay Kirtane博士则认为,在不清楚血栓事件真正发生率的情况下,采用全剂量或部分剂量药物进行经验性抗凝治疗,仍存在争议。
COVID-19患者的抗凝治疗
多个学会发布了实践指南,对抗凝治疗策略进行了推荐。国际血栓与止血学会建议,所有住院的COVID-19患者,即使不在重症监护病房,也应接受预防剂量的低分子量肝素治疗,除外有禁忌证的患者(存在活动性出血且血小板计数<25×109 /L)。英国指南还呼吁所有高危患者都应进行静脉血栓栓塞的预防,对于突发氧合恶化、呼吸窘迫和血压降低的患者应考虑肺栓塞的预防。指南建议使用低分子量肝素而不是口服抗凝药进行治疗,即使通常服用直接口服抗凝药或维生素K拮抗剂的患者也应更换药物。
杜克大学卫生系统心血管危重监护主任Jason Katz博士指出,多个医疗机构正在考虑开始系统抗凝治疗的临界值,如D-二聚体> 1500 ng/mL和纤维蛋白原>800 mg/mL。但鉴于证据量很小,Jason Katz博士认为,个性化处理病例更合理。
炎症在COVID-19的疾病发展中具有重要作用,普通肝素具有抗炎作用,理论上应优先考虑,而低分子肝素的抗炎作用较小,直接口服抗凝药则更少。此外,普通肝素还具有一个优势,即如果发生出血,可以迅速停药。
但在纽约市的Montefiore等多家医疗中心都选择了直接口服抗凝药进行治疗,原因是不希望护士每天两次或三次进入病人房间给予普通肝素或调整静脉内普通肝素,给予患者口服抗凝药要更容易。
COVID-19导致凝血的机制有待探索
埃默里大学医学院传染病学Carlos del Rio博士在前几日召开的美国传染病学会主办的媒体简报会上,特别讨论了COVID-19感染导致高凝状态的问题,但其发生机制目前尚不清楚。
中国医学科学院呼吸病学研究院、中日友好医院曹彬教授指出,该机制可能与内皮损伤有关。导致COVID-19疾病的SARS-CoV-2病毒通过血管紧张素转化酶2(ACE2)受体进入细胞,这些受体最常见于肺泡上皮细胞,其次是内皮细胞。当病毒与这些细胞结合时,可能会损害血管,特别是小血管的微循环,从而刺激血小板聚集。
对此,中国人民解放军总医院陈韵岱教授补充,尸体解剖也显示出心脏的炎性改变,伴有细微的间质单核细胞炎性浸润,但没有病毒包涵体。其他可能的心肌损伤机制还包括缺氧引起的心肌损伤、心肌微血管损伤和全身炎症反应综合征。
由此,治疗方法的选择应基于哪种机制占主导地位。如果血栓是多器官衰竭的主要原因,那么抗凝治疗很重要,但抗凝治疗显然会导致更高的出血风险;所以如果抗凝不是主要机制,就不需要使用抗凝药物。Stephan Moll博士认为,进一步的尸体解剖报告,以及将这些发现与临床过程相关联的研究,将对解决这一问题起到重要作用。
参考来源:
1. Yan Zhang, Meng Xiao, et al. Coagulopathy and Antiphospholipid Antibodies in Patients with Covid-19. New England Journal of Medicine. April 8, 2020.
2. Megan Brooks. 'Hypercoagulation,' Antiphospholipid Antibodies Seen in COVID-19. Medscape. April 14, 2020.
3. Crystal Phend. Anticoagulation Guidance Emerging for Severe COVID-19 — Pragmatic choices dominate as guidelines are shaping up. MedPage Today. April 8, 2020.
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






