猪流行性腹泻病毒的进化演变(流行病学猪流行性腹泻病毒云南省流行毒株S1基因序列分析)
摘要:为深入了解云南省猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)的流行现状及现有疫苗株的保护效果,从2017—2022年云南省PEDV感染临床阳性样品中扩增出9份样品的PEDV S1基因,利用生物信息学方法,对9份样品S1基因进行了遗传进化树构建、同源性分析和氨基酸突变位点分析等。结果显示:2份样品位于G1基因群,其余7份位于G2基因群的G2b基因亚群。7份G2b基因亚群样品的核苷酸和推导氨基酸同源性较高,与G2基因群的AJ1102和L/W/L疫苗株处于不同基因亚群且同源性较低,并在第13、139、289和363位发生了不一致的突变位点;与现有疫苗株相比,在抗原中和位点COE区域以及其他区域,有明显的抗原性变化。结果表明:云南省存在G1基因群和G2b基因亚群PEDV同时流行,但以G2b基因亚群为主;流行株和疫苗株间存在较远的遗传和亲缘关系,以及氨基酸突变和抗原性差异,这很可能是导致目前PED控制不理想的原因,因此需要研发安全有效的疫苗。
猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的猪流行性腹泻(PED)是养猪业中最常见、危害较严重的病毒性腹泻病,具有高传染性、高致病性和季节性暴发特征。仔猪由于生理机能尚未发育完善,体内抗体水平低,通常最易感染PEDV。疫苗免疫在PED防控中起重要作用,但近年来免疫猪只也频繁发生PED。相关报道和多项研究已证实,PEDV目前已发生基因突变出现新的变种,并且这种基因突变主要发生在S1基因,这或是造成免疫失败的原因。
PEDV为尼多病毒目冠状病毒科冠状病毒属的,单股正链有囊膜结构的RNA病毒,基因组长约28 kb,包括2个非编码区和7个开放阅读框(ORF)。这7个开放阅读框编码4个结构蛋白(S、E、M、N)与3个非结构蛋白(ORF1a、ORF1b和ORF3)。其中,S基因全长4 152 bp,其编码的S蛋白是位于病毒粒子表面的纤突蛋白,在PEDV与宿主细胞表面受体结合和入侵宿主细胞过程中起着巨大作用,同时还与介导动物机体产生抗体有着重要联系,被认为是能够抵抗PEDV的主要抗原。根据其他冠状病毒S蛋白序列可以将PEDV人为划分为S1(1~735 aa,抗原区)和S2(736~1 383 aa,膜融合区)两个结构域。研究表明,S1结构域易发生变异,能够更好地适合多种宿主细胞,更能体现病毒变异情况。因此研究S1基因有利于了解、分析毒株特点与变异趋向。本研究对2017年以来采自云南省疑似PED发病猪只的病料样品进行PEDV检测,然后对检出的阳性样品进行S1基因测序分析,以期为PED防制提供依据。
材料与方法
样品来源
采自云南省12个地区部分猪场腹泻仔猪的粪便样品120份、小肠组织样品62份,共计182份(表1)。

主要试剂和仪器
RNA提取试剂盒、胶回收试剂盒、质粒提取试剂盒、DL 2 000和DL 5 000 DNA Marker,购自宝生物工程有限公司;2×Easy Taq Super Mix、感受态细胞DH5α、PMD19-T载体、AMP、IPTG、X-gal,购自北京全式金生物技术有限公司;LB肉汤、LB琼脂,购自广东环凯微生物科技有限公司。试验所用仪器,均由云南农业大学动物医学院实验室提供。
引物设计与合成
参考GenBank中PEDV毒株N基因保守区和CV777株全基因序列(登录号AF353511),分别设计PEDV检测引物(F、R)和S1基因扩增测序引物(SF1/SR1、SF2/SR2),由昆明擎科生物科技有限公司合成。检测引物序列见表2。

总RNA提取,目的基因扩增、克隆及基因测序
根据试剂盒说明书提取RNA,配制cDNA反转录体系(20.0 μL):5×TransScript All-in-One SuperMix For PCR 4.0 μL、RNase-free water 8.0 μL、Total-RNA 8.0 μL。反转录程序:42 ℃ 30 min,85 ℃ 5 s。产物于-20 ℃保存。PCR检测反应体系(25.0 μL):2×Easy Taq Super Mix 12.5 μL,ddH2O 9.5 μL,F、R引物各1.0 μL,模板1.0 μL。PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸1 min,扩增32个循环;72 ℃延伸5 min。PCR产物用1%琼脂糖凝胶电泳鉴定。S1基因前段(SF1/SR1)PCR扩增反应程序:94 ℃预变性3 min;94 ℃变性30 s,54.6 ℃ 30 s,72 ℃ 100 s,34个循环。后段(SF2/SR2)PCR反应程序:94 ℃预变性3 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 80 s,扩增34个循环。DNA产物用胶回收试剂纯化,连接至pMD19-T载体,转化至感受态细胞DH5α,提取重组克隆质粒进行PCR鉴定,并送昆明擎科生物科技有限公司测序。
S1基因序列分析
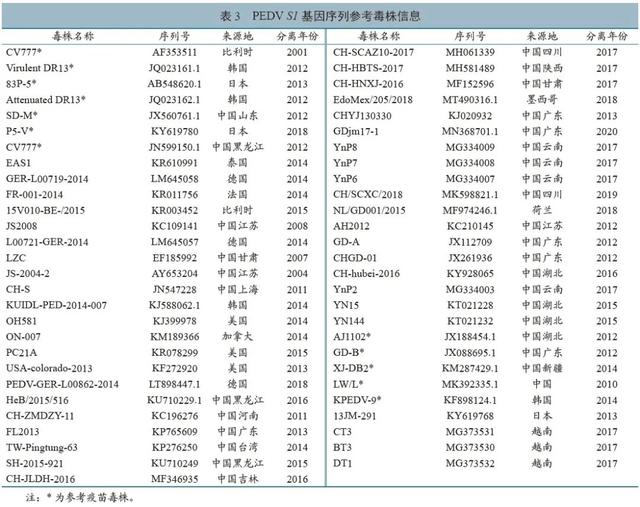
利用DNAstar软件对测序获得的两段S1基因进行拼接,获得2 376 bp序列;利用MEGA7.0及itol在线软件,进行同源性、氨基酸变异位点分析,以及遗传进化树构建、修饰和标定。利用DNAstar中的Jameson-Wolf法进行抗原性变化分析。参考序列与疫苗株信息见表3。
结果与分析
对2017—2022年云南省12个地区的182份腹泻仔猪样品进行RT-PCR检测,结果在9个地区的110份样品中检出PEDV阳性,样品阳性率为61.20%。选取代表性样品进行基因测序及拼接,共获得9个样品的S1序列,分别命名为YN-QJ-2017(曲靖)、YN-MZ-2018(蒙自)、YN-XW-2018(宣威)、YN-JS-2019(建水)、YN-DLXG-2020(大理)、YN-LJ-2020(丽江)、YN-BS-202(保山)、YN-CJ-2021(澄江)、YN-XW-2022(宣威)。
样品RT-PCR检测
样品RT-PCR扩增产物的1%琼脂糖凝胶电泳检测结果(图1)显示,在778 bp左右位置出现清晰的特异性条带,与预期相符。

S1基因扩增纯化、克隆及鉴定
对检测阳性的样品,用引物S1F/S1R、S2F/S2R,对S1全基因序列分两段进行RT-PCR扩增,扩增产物用1%琼脂糖凝胶电泳分析,结果在约1 516、1 187 bp位置可见清晰的特异性扩增条带(图2),与预期目的片段大小一致。对纯化的PCR产物进行克隆、鉴定及测序,得到与预期结果一致的大小约1 516 bp和1 187 bp(图3)的目的片段,从而确定重组质粒pMD-19-S1-1和pMD-19-S1-2构建成功。

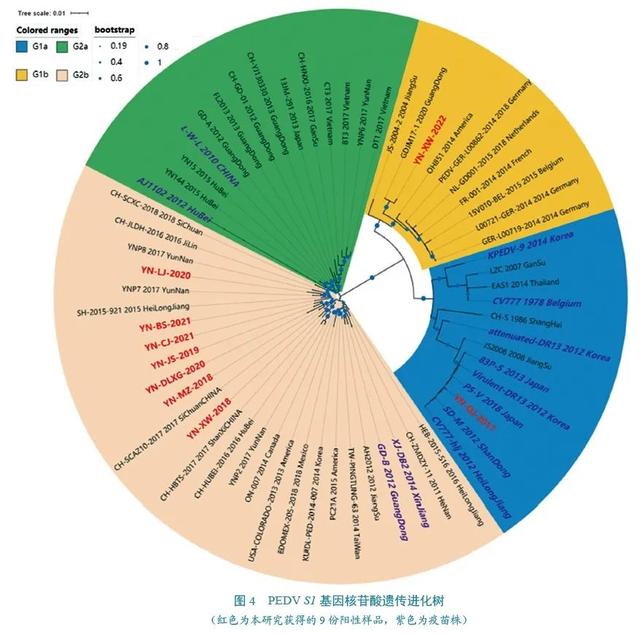
S1基因核苷酸遗传进化分析
S1基因遗传进化分析结果(图4)显示,所构建的遗传进化树主要分为两个大分支,即G1和G2基因群,其中G1基因群包括G1a亚群(经典株)、G1b亚群(变异株),G2基因群包括G2a和G2b亚群。本研究获得的9份样品S1基因可分为1份G1a亚群(YN-QJ-2017)、1份G1b亚群(YN-XW-2022)和7份G2b亚群。其中,YN-QJ-2017与国内疫苗株SD-M、CV777-hlj和P5-V亲缘关系最近,7份G2b基因亚群样品与2011—2018年的4株北美洲毒株、1株韩国毒株、18株国内流行毒株(包括3株云南株)和2株国内疫苗株位于同一个分支,与国内市售G2基因群疫苗株(AJ1102、L/W/L)亲缘关系较远,而该分支也包含了国内外最近几年的许多主要流行毒株。
S1基因核苷酸及推导氨基酸序列同源性分析
对 9份阳性样品与35株代表性PEDV参考毒株进行S1基因核苷酸和推导氨基酸序列同源性分析。结果显示:2份G1基因群样品与7份G2基因群样品的核苷酸和推导氨基酸同源性分别为93.1%~93.6%和91.1%~91.9%。7份G2b基因亚群样品与CV777、CH-S及CV777、P5-V、KPEDV-9、83P-5、SD-M及DR13等疫苗株的亲缘关系很远,它们间的核苷酸和推导氨基酸同源性分别为91.3%~93.1%和89.4%~92%;与AJ1102和L/W/L疫苗株以及国内的高致病性变异强毒株CHYJ130330、变异减毒株FL2013、云南流行毒株YNP6等参考毒株位于不同分支,它们间的核苷酸和推导氨基酸同源性分别为96.1%~98.7%和89.9%~97.9%;而与同一分支的美国变异强毒株USA-Colorador-2013以及国内的TW-Pingtung-63、CH-hubei-2016、CH-JLDH-2016等变异流行毒株亲缘关系最近,它们间的核苷酸和氨基酸同源性分别为97.5%~99.2%和96.5%~98.6%,说明存在共同祖先,具有密切关系;与3株云南参考株的核苷酸和推导氨基酸同源性较高,分别为97.6%~98.8%和96.2%~98.2%;与同一分支的国内疫苗株GD-B和XJ-DB2的核苷酸和推导氨基酸同源性较高,分别为97.0%~97.7%和95.6%~97.6%。
S1基因与疫苗株氨基酸突变位点分析
结合系统发育分析结果可知;处于G1基因群的阳性样品YN-XW-2022与同群的疫苗株存在较多一致的突变位点,与G2基因群疫苗株和阳性样品在第2、15、361、370、522、554、599、724、729和771位发生了一致的突变,分别为R→K、P→S、I→T、E→Q、A→S、T→S、G→S、N→S、N→S、Y→S,此外在第3、42、71、87、152、168、226、306、333 和568位还发生了与G1和G2基因群疫苗株均不一致的突变位点,分别为I→N、Q→H、I→L、S→A、K→R、I→L、G→S、D→G、A→V、K→N;处于G2基因群的7份阳性样品与AJ1102、XJ-DB24等4株疫苗株在第13、139、289和363位发生了不一致的突变位点,分别为V→L、N→D、I→M、A→T。这提示,现有的G2基因群疫苗株对现有流行毒株不能提供完全保护甚至发生免疫失败现象。

S1蛋白抗原位点变化分析
S1蛋白主要抗原中和位点存在于COE和SS2区域。阳性样品与疫苗株(CV777、LW/L、AJ1102)的S1抗原位点分析结果(图6)显示:处于G1分支的2份样品与同源经典疫苗株CV777相比抗原性差异较小,但YN-QJ-2017株S1蛋白主要抗原中和表位COE区域在第605~613 位明显增加,第540~548 位明显减少。处于G2分支的疫苗株与阳性样品YN-MZ-2018、YN-JS-2019、YN-DLXG-2020和YN-CJ-2021在第240~254 位明显减少,与YN-XW-2018在第320~326位明显减少,与YN-JS-2019在第389~404位明显减少;在COE区域,YN-CJ-2021的第502~510位,YN-LJ-2020的第529~537、605~613位,YN-JS-2019的第540~548位明显减少。这可能导致云南省流行毒株与疫苗株在抗原性上存在差异。

讨论
2010年以来,PED的暴发流行给我国养猪业造成了巨大经济损失。Zuo等对2012—2017年从云南省采集的435份猪腹泻样品检测发现,PEDV样品阳性率逐年上升。本研究从2017—2022年阳性样品中扩增得到9份样品PEDV S1基因,且样品来源猪群均已接种CV777、AJ1102和L/W/L株疫苗,说明这些疫苗株未能对PEDV流行提供很好的预防。通过S1基因遗产进化和同源性分析得知,9份PEDV阳性样品位于G1基因群和G2b基因亚群。这两种基因型毒株也导致了美国和韩国PED疫情暴发。李晓成等分析2017年我国猪群腹泻疫病流行状况,发现PEDV为主要病原,其中G2基因群占90%,说明G2基因群是我国的优势流行株;杨汉春等对我国部分省份进行PEDV S1基因检测也得出相同的结论。可以看出,云南省和国内其他地区当前的PEDV流行株基本一致。从疫苗株的S1蛋白氨基酸突变位点分析来看,2份G1基因群样品和7份G2基因群样品与各自同群的疫苗株均存在较多相同的突变位点,但也存在不一致的突变位点。值得注意的是,G1基因群样品YN-XW-2022与G2基因群样品和疫苗株在第1~163位存在10处一致的突变位点,同时也存在9处与G1和G2基因群毒株都不一致的突变位点。这提示PEDV流行毒株在疫苗免疫和繁育过程中可能发生了G1和G2基因群的基因重组或变异现象。Cuo等对PEDV流行毒株进行遗传进化和基因型分析,发现存在G1和G2基因群重组毒株。王若木等研究G2基因型PEDV疫苗免疫后的毒株遗传进化特点发现,广西地区PEDV毒株在免疫压力下S1蛋白氨基酸序列发生了独特的突变。从这方面看,流行毒株S1蛋白的这一系列变化可能会导致云南省PED免疫失败。
PEDV S蛋白与细胞表面受体结合、入侵宿主细胞以及介导动物机体产生抗体有着重要联系,是研发疫苗的首要目的蛋白;不同毒株S基因间存在不同程度的核苷酸插入、缺失和突变等现象,进而影响其抗原性。Chen等通过PEDV变异株基因序列分析,首次公布了PEDV变异株的主要变异区为S1基因。朱海侠等通过分析4株分离株与疫苗株PEDV S1基因主要抗原表位区抗原位点变化,推测抗原表位变化可能是影响PEDV感染的主要原因。因此,通过PEDV S1基因主要抗原表位区的位点变化,结合遗传进化和同源性分析,比较分离株与疫苗株S1基因的差异,可推测现有疫苗的保护情况。本研究发现,阳性样品与不同基因群的3株疫苗株相比,在S1蛋白主要抗原中和表位区COE区域和以外区域均出现了不同程度变化,提示现有疫苗对云南省PEDV流行毒株不具有较好的免疫效果,迫切需要研发能保护猪只免受新型PEDV攻击,并且安全、有效以及低价的疫苗。
结论
综上所述,云南省部分地区同时流行G1基因群和G2b基因亚群两种PEDV基因型毒株,但G2b为优势流行基因亚型,其与同群的北美洲毒株有密切亲缘关系;云南流行株和疫苗株间存在较远的遗传亲缘关系,已发生了部分氨基酸突变,尤其在抗原表位区,推测现有疫苗株对云南省部分PEDV流行毒株不具有较好的保护效果,这很可能是导致现在PED控制不理想的原因。
《猪流行性腹泻病毒云南省流行毒株S1基因序列分析》详情请点击“阅读原文”。
(责任编辑:朱迪国)

《中国动物检疫》是由农业农村部主管,中国动物卫生与流行病学中心主办的、我国动物卫生监督、管理、防疫、检疫领域权威的国家级指导性科技期刊,是兽医系统内专家、学者交流学术创新,反映基层实践,报道疫情处置动态的重要宣传平台和窗口。欢迎您积极投稿、建言献策,投稿网址:http://zgdwjy.cahec.cn,0532-85623545。《猪流行性腹泻病毒云南省流行毒株S1基因序列分析》作者王鑫文等9人已将本文在《中国动物检疫》2022年第9期发表。本文为原创信息,转载请标明出处:中国动物检疫。
更多
详情
敬请
关注
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






