晚期胰腺癌如何取得病理诊断(胰腺癌术后辅助治疗)
第31期肝胆胰肿瘤资讯~
本期提要
-
胰腺癌术后辅助治疗,病理特征有话语权!
-
新的胰腺癌易感基因的鉴别,有望开拓研究方向?
-
CARRIE :MM-141联合标准治疗未能进一步改善晚期胰腺癌患者预后!
一
胰腺癌术后辅助治疗,病理特征有话语权!
近期来自美国维克森林大学肿瘤外科的研究者通过大样本数据,回顾性分析、探讨了胰腺癌导管腺癌(PDAC)患者经手术切除后的最佳辅助治疗方法。结果发现,在具有高危病理特征(淋巴结或切缘受累或脉管癌栓)的人群中,序贯化疗及放疗比单纯化疗更具有生存优势。研究在线发表于外科学顶级期刊《Annals of Surgery》。

研究发表在《Annals of Surgery》
PDAC治疗效果不佳,早期患者术后最佳辅助治疗仍存在争议。研究者对美国国家癌症数据库2010-2014年行手术切除的早期PDAC患者进行了回顾性分析,根据病理特征进行分层,目的是探讨不同亚组患者辅助治疗的临床效果。
研究共纳入了16709例行手术切除的PDAC患者,10825例(64.8%)患者接受了术后辅助治疗。最常见的辅助治疗方法为辅助化疗,占5901例(35.4%);其次为序贯化-放疗(C-RT)共4488例,占26.9%;序贯放-化疗(RT-C)共291例(1.8%);单纯放疗(RT)占145例(0.9%)。总体中位随访时间为42.9个月,中位生存时间为22.1个月。
多因素分析中,肿瘤大小、分级、阳性切缘、淋巴累犯、脉管侵犯(LVI)、分期、阳性淋巴结比率、未接受化疗和/或放疗是生存期减少的预测因素。
-
在至少存在1个高危病理特征(淋巴结或切缘受累或LVI)的人群中,序贯化、放疗相比单纯化疗显示出明显生存获益[经倾向性评分匹配后,中位总生存期(OS)24.8个月 vs 21.0个月,HR:0.81,95%CI:0.77-0.86,P<0.001]。
-
但在无高危病理特征患者中序贯化放疗相比单纯化疗对OS的影响并不显著(经倾向性评分匹配后,中位OS 54.6个月 vs 42.7个月,HR:0.90,95% CI: 0.75-1.08,P=0.25)。
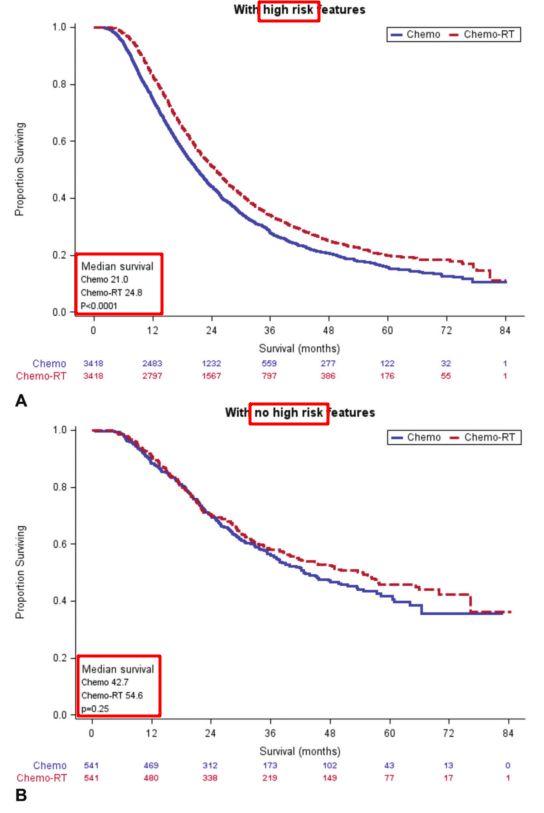
有/无高危病理特征人群中,C-RT与单纯化疗生存曲线
★ 小结
该研究是目前最全面的手术后辅助治疗的回顾性分析,一定程度上反映了目前胰腺癌术后治疗的现状。该研究认为高危病理特征(包括淋巴结状态、切缘状态和LVI) 患者的辅助治疗方式对生存具有显著的影响。在至少存在一种高危病理特征的情况下,序贯化疗 放疗与常规化疗相比,具有显著的生存获益。二
新的胰腺癌易感基因的鉴别,有望开拓研究方向?
来自美国国家癌症研究所的人员联合欧洲多个国家的癌症中心,通过整合基因表达及基因型数据,发现了新的胰腺癌风险位点和相关功能基因,为未来的研究提供了方向。研究结果发表在《Journal of the National Cancer Institute》。
研究发表在《Journal of the National Cancer Institute》
虽然目前通过全基因组关联研究(GWAS)在欧洲人群中发现了20个胰腺癌易感位点,但其遗传性仍未得到明确解释,多数相关基因仍然处于未知状态。为了寻找新的胰腺癌风险位点和可能的致病基因,来自美国的研究者联合欧洲多中心在欧洲人群中采用FUSION、MetaXcan以及SMulTiXcan进行了胰腺癌转录组相关研究(TWAS)。
该研究者们集成整合GWAS中的9040例胰腺癌和12496例正常对照的统计数据,利用正常胰腺组织的转录组数据建立基因表达预测模型。
最终,研究者共鉴别出25个与胰腺癌风险的相关性具有统计学意义基因 (FDR < 0.05),包括14个位于11个新位点的候选基因(1p36.12: CELA3B; 9q31.1: SMC2, SMC2-AS1; 10q23.31: RP11-80H5.9; 12q13.13: SMUG1; 14q32.33: BTBD6; 15q23: HEXA; 15q26.1: RCCD1; 17q12: PNMT, CDK12, PGAP3; 17q22: SUPT4H1; 18q11.22: RP11-888D10.3; and 19p13.11: PGPEP1) 以及11个位于已知位点的基因(5p15.33: TERT, CLPTM1L, ZDHHC11B; 7p14.1: INHBA; 9q34.2: ABO; 13q12.2: PDX1; 13q22.1: KLF5; and 16q23.1: WDR59, CFDP1, BCAR1, TMEM170A)。
25个与胰腺癌风险显著相关的基因
经过Bonferroni校正后,这些基因中的12个(新风险位点处的CELA3B、SMC2和PNMT,以及已知位点的TERT、CLPTM1L、INHBA、ABO、PDX1、KLF5、WDR59、CFDP1和BCAR1)的相关性仍具有统计学意义。
★ 小结
该研究新鉴别出25个与胰腺癌风险相关(FDR<0.05)的基因,其中有14个位于新的基因组位点。共有12个基因在Bonferroni校正后仍具有统计学意义。该研究的发现为胰腺癌风险的遗传基础提供了新的证据,并为未来的功能、机制研究奠定了基础。三
CARRIE :MM-141联合标准治疗未能进一步改善晚期胰腺癌患者预后
近日,来自美国MD安德森癌症中心的研究者在《Annals of Oncology》上正式发表II期CARRIE研究研究结果:在白蛋白
结合型紫杉醇 吉西他滨标准化疗的基础上,加用Istiratumab(MM-141)一线治疗转移性胰腺癌未能进一步提高效果。实际上,之前Merrimack制药公司就公布了该研究的结果,并表示由于Istiratumab未能达到其主要或次要临床终点,将不会投入更多资源来开发Istiratumab。
研究发表在《Annals of Oncology》
临床前数据表明,双重阻断胰岛素样生长因子-1受体(IGF-1R)和HER3通路在PDAC中比单独阻断IGF-1R更有效果。Istiratumab是一种IGF-1R和ErbB3 的双特异性抗体, CARRIE是一项国际多中心、随机、双盲、安慰剂对照的II期研究,目的是评估在血清高水平IGF-1的转移性PDAC患者中,Istiratumab是否能够增强标准治疗方案(白蛋白
结合型紫杉醇 吉西他滨)的效果。
研究将高IGF-1水平的患者按照1:1随机分组为每2周静脉注射Istiratumab 2.8 g或安慰剂。同时所有患者均同时接受标准剂量吉西他滨 白蛋白
结合型紫杉醇治疗。共同研究终点为高IGF-1水平患者的无进展生存(PFS)、以及高IGF-1/HRG阳性患者的PFS。主要的次要终点为OS、客观缓解率(ORR)、不良事件(AEs)。
88例患者被随机分为2组(三药组43例,对照组45例)。在高IGF-1亚组中,三药组和对照组的PFS中位数分别为3.6个月和7.3个月(HR:1.88,P=0.027)。在高IGF-1/HRG阳性亚组中(n=44),三药联合与对照组中位PFS分别为4.1个月和7.3个月,(HR:1.39,P=0.42)。两组总体的中位OS和ORR相似。
三药组PFS未能得到改善
尽管低级别AEs在三药组(39.5%)相比对照组(24.4%)中导致早期停药的比例更高,但在3级及以上的AEs中两组未观察到明显的差异。
★ 小结
在高IGF-1水平(无论肿瘤HRG是否阳性)转移性胰腺癌患者的标准一线化疗中添加IGF-1R-和ErbB3的双特异性抗体Istiratumab并未能改善患者PFS、OS。作者认为在该部分患者中,这种双特异性抗体似乎应该停止进一步的临床开发。参考文献
[1]Moaven, O., et al., Optimal Adjuvant Treatment
Approach After Upfront Resection of Pancreatic Cancer: Revisiting the Role of Radiation Based on Pathologic Features. Ann Surg, 2020.
[2]Zhong, J., et al., A Transcriptome-Wide Association Study (TWAS) Identifies Novel Candidate Susceptibility Genes for Pancreatic Cancer. J Natl Cancer Inst, 2020.
[3]Kundranda, M., et al., Randomized, double-blind, placebo-controlled phase II study of istiratumab (MM-141) plus nab-paclitaxel and gemcitabine versus nab-paclitaxel and gemcitabine in front-line metastatic pancreatic cancer (CARRIE). Ann Oncol, 2020. 31(1): p. 79-87.
本文首发:医学界肿瘤频道
本文作者:粗人
责任编辑:Sharon
版权申明
本文原创 如需转载请联系授权
- End -
,
免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com











