胰腺癌手术切除后靶向化疗管用吗(一位胰腺癌患者经免疫联合同步放化疗后手术)
引言:
胰腺癌常常因为起病隐匿且进展快而导致大多数患者在确诊时已属于局部晚期或有远处转移而丧失手术机会,即使是可手术的患者也有50%左右的人会在术后1年出现复发转移。因此目前越来越多的证据支持有高危因素的可切除胰腺癌患者行新辅助治疗,对于交界可切除和局部晚期的胰腺癌患者主张行转化治疗后再手术。
基本病史:
患者男性,62岁。2021年9月10号因“间断上腹部疼痛伴腹胀2月”就诊。
诊断过程:
血清肿瘤标记物:CA199:3958U/ml,CA125:50.3U/ml↑,CT示胰头占位伴周围脂肪间隙模糊,考虑胰腺癌,病灶与肠系膜上静脉有接触。PET-CT示胰头钩突区软组织团块伴周围散在稍大淋巴结(大小约4.1*3.6cm,SUVmax=18.2,与邻近十二指肠降部分界不清),葡萄糖代谢显著增高,考虑胰腺钩突癌伴周围淋巴结及邻近十二指肠受累可能大。后在消化科行EUS-FNA穿刺,病理示查见胰腺癌。遂明确诊断为胰腺癌(钩突部,交界可切除)。经胰腺肿瘤多学科MDT团队讨论后建议先至肿瘤科行转化治疗。
治疗经过:
患者于2021-09-23至2022-01-08在肿瘤科行AG方案(白蛋白紫杉醇 吉西他滨)化疗联合替雷利珠单抗治疗4周期。期间于2021-11-15至2021-11-26同步行胰腺病灶三维调强放射治疗(IMRT),具体剂量为:PGTV:5Gy*10f,PTV:3Gy*10f。具体治疗流程如下(图1)。治疗期间每两周期复查CT,2周期及4周期后病灶持续显著缩小,疗效评估均为部分缓解(PR),治疗后CA199降至51.4U/ml,4周期后复查PET-CT示病灶缩小至2.3*1.5cm,SUVmax=4.8,周围淋巴结代谢恢复正常(图2,3)。

图1 治疗流程示意图
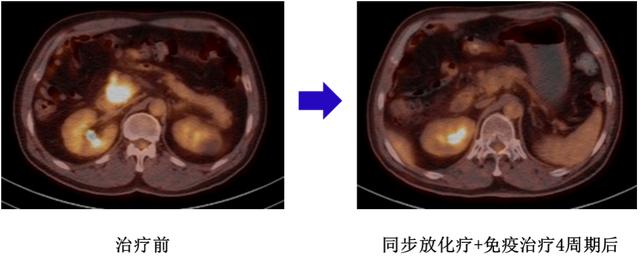
图2 治疗前后病灶PET-CT变化:病灶缩小,代谢减低(治疗前SUVmax18.2vs治疗后SUVmax4.8)

图3 患者治疗期间CA19-9变化趋势
于2022-02-15行我院胆胰外科行胰十二指肠切除(PPPD)+肠系膜上静脉切除、人工血管重建+区域淋巴结廓清+腹腔淋巴结活检+胰周神经切除术。

图4 术后病理照片显示瘤床内未见残留癌细胞
术后病理示钩突处切面呈灰白色疤痕状,范围2.8cm*2.5cm*2cm,符合胰腺导管腺癌伴重度治疗反应(病理完全缓解pCR)。7张瘤床切片中均未见明确癌组织(即残留的癌组织占瘤床的0%)。胰腺癌治疗反应病理评分(Evans分级:IV级;CAP评分:0分;MD anderson分级:0级)。标本各切缘均未见癌组织累及。周围淋巴结16枚均未见癌转移。病理分期:0期(ypT0,ypN0,cM0)(图4)。
讨论:
近年来免疫检查点抑制剂在实体瘤中的治疗作用逐渐成为研发热点,在肺癌、食管癌、头颈部肿瘤等的治疗中均显示出了喜人的效果,但是免疫单药在胰腺癌中的治疗效果欠佳。胰腺癌一般被称作“冷肿瘤”,主要是因其肿瘤微环境差,免疫活性细胞难以发挥作用[1]。
近3年,我中心率先开展了局晚期胃癌的同步放化疗联合免疫检查点抑制剂的整合治疗新模式,发现病理完全缓解率高达43%。受此鼓舞 ,我们于2021年起开展了一项同步放化疗联合免疫检查点抑制剂治疗潜在可切除胰腺癌的转化治疗研究,旨在通过化疗、放疗促进免疫治疗的作用,提高潜在可切除胰腺癌患者的客观缓解率、手术R0切除率,延长患者的生存期。目前已入组25例患者,疾病控制率达到100%,其中10例患者转化治疗后行手术切除,9例达到了R0切除,2例患者达到病理完全缓解(pCR)。
胰腺癌属于放疗中度敏感的肿瘤,常规放疗的剂量通常受到十二指肠、小肠、胃、肝脏等正常器官耐受量的限制,无法对肿瘤予以有效控制。然而更高剂量的常规放疗可能对肿瘤周围的正常脏器造成严重的放射性损伤。既往研究发现胰腺肿瘤放疗的生物有效剂量越高,肿瘤的局部控制率就越好。IMRT(三维调强放疗)是在三维适形放疗技术上发展起来的,除了完全具备适形放疗的优点外,IMRT技术可实现照射野内的剂量强度调节,提高肿瘤部位单次照射剂量的同时尽量保护周围的正常组织和器官,比常规剂量的放疗对于局部晚期胰腺癌的效果更佳[2]。因此,我们采用了IMRT技术进行了高剂量的放疗,在有效保护周围正常组织的前提下尽量提高肿瘤部位的照射剂量,再联合免疫治疗和化疗协同抗肿瘤,提高了局部治疗效果,而且术前的放化疗并没有增加手术风险和术后的并发症。
近年来病理学评估(病理缓解程度,包括完全病理缓解[pCR]和主要病理缓解[MPR])越来越受到重视。pCR定义为在原发性肿瘤或清扫的淋巴结中没有残留的活性肿瘤细胞。多项研究显示乳腺癌患者新辅助化疗后的pCR可预测其生存期,并已获得FDA和EMA批准,可作为乳腺癌新辅助研究生存的替代终点。CA209-8Y9研究将病理缓解作为NSCLC新辅助治疗的早期终点,其研究结果显示与未达到pCR的患者比较,获得pCR的患者死亡风险降低50%,显示病理缓解和生存终点具有强相关性[3]。本文病例经过四个周期的放化疗联合替雷利珠单抗的转化治疗后成功行手术切除,术后病理示pCR。因此,可以预期该患者的pCR可为其来带来更长的生存获益。
撰写:杜娟(南京大学医学院附属鼓楼医院肿瘤中心 主任医师 硕导)
修改:刘宝瑞(南京大学医学院附属鼓楼医院肿瘤中心 主任医师 教授 博导)
参考文献:
[1] Ostios-Garcia L, Villamayor J, Garcia-Lorenzo E, et al. Understanding the immune response and the current landscape of immunotherapy in pancreatic cancer[J]. World J Gastroenterol, 2021, 27(40): 6775-6793.·doi:10.3748/wjg.v27.i40.6775.
[2] Murphy JE, Wo JY, Ryan DP, et al. Total Neoadjuvant Therapy With FOLFIRINOX in Combination With Losartan Followed by Chemoradiotherapy for Locally Advanced Pancreatic Cancer: A Phase 2 Clinical Trial[J]. JAMA Oncol, 2019, 5(7): 1020-1027.·doi:10.1001/jamaoncol.2019.0892.
[3] N.A. Waser, A. Adam, B. Schweikert, et al. 1243P Pathologic response as early endpoint for survival following neoadjuvant therapy (NEO-AT) in resectable non-small cell lung cancer (rNSCLC): Systematic literature review and meta-analysis. [J]. Annals of Oncology, 2020, 31(S4): S806.
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






