wb注意事项(新手也能做出满意结果)

解螺旋公众号·陪伴你科研的第1929天
Western Bolt实用小细节
Western blot(WB)是检测蛋白质及蛋白质翻译后修饰的经典方法,可在简单或复杂的生物样品中提供有关靶蛋白的半定量或定量数据。WB步骤复杂,通常包括:
蛋白样本制备→电泳→转膜→封闭→孵育一抗→孵育二抗→显影→分析。

WB任何过程出现Bug均可影响结果的重复性与灵敏度,因此必须注意将WB的每个步骤标准化。今天给大家分享WB各个过程中需要注意的细节!
1
样品制备
有效的样品制备是影响WB可重复性的非常重要的因素。需考虑以下问题:
1、靶蛋白是可溶/不可溶蛋白,细胞质/膜蛋白?2、溶解的蛋白或其翻译后修饰的维持是否需要添加额外的缓冲成分(例如洗涤剂、酶抑制剂)?
3、蛋白质定量的方法是什么,缓冲成分会干扰蛋白定量吗?
BCA蛋白定量检测法是总蛋白质定量的常用方法,其蛋白间差异较考马斯染料法的更小,但与还原剂、螯合剂不兼容(兼容去垢剂)。
2
电泳

1、最合适的凝胶浓度是什么?不同分子量的蛋白分离胶浓度对应表:

2、哪种电泳缓冲液最合适?
例如,3-(N-吗啡啉)丙磺酸缓冲液(MOPS缓冲液)适合~75KDa的蛋白质,2-(N-吗啉基)乙磺酸缓冲液(MES缓冲液)适合<36KDa的蛋白质。
3、电泳多长时间和以及电泳条件?
4、蛋白质的分子量迁移情况如何?蛋白质的分子量迁移因凝胶类型、浓度和电泳缓冲液的不同而不同。对应情况如下:
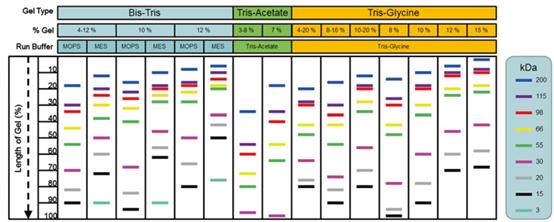
3
转膜

1、什么是最合适的膜?例如,PVDF膜或NC膜(0.45μm)。PVDF膜有两种规格,0.45μm的膜适用于检测大于20KDa的蛋白质,0.2μm膜适用于小于20的蛋白质。PVDF需要在甲醇中浸泡1-2min激活。
不同分子量蛋白转膜条件:

大于150KDa蛋白可恒压20V 4度湿转过夜。
2、转膜液甲醇浓度如何?
小分子量蛋白的转膜需要注意:(1)高浓度的凝胶有利于小分子量蛋白的分离。一般在目的蛋白离凝胶前沿0.5-1cm时停止电泳,太靠近凝胶前沿易引起边缘效应。
(2)SDS阻止蛋白与膜的结合,小蛋白更是如此。因此电转液中可以不加SDS。
(3)保持甲醇浓度20%。
大分子量蛋白的转膜需要注意:
(1) 而甲醇易使SDS从蛋白上脱离,因此适当降低甲醇浓度至10%或更低,防止蛋白沉淀。
(2) 降低电转液中甲醇的含量,这样可以促进凝胶的膨胀,更易于大分子量蛋白的转出。
(3) 使用硝酸纤维素膜时,甲醇是必需的。如果是PVDF膜,甲醇可以不必加入电转液,但需要预先用甲醇活化。
3、是否应进行膜染色以评估转膜效率?
丽春红染色可在膜上看见清晰、连续的粉红色条带,无白色圈圈出现。转膜不佳时,条带色淡、有气泡,甚至无条带。
4
封闭
封闭液中可与固相载体表面的空白位置结合,同样以机械填补(堆积)和吸附覆盖的方式结合在膜上。
1、何种封闭液最合适(例如BSA或脱脂牛奶)?
脱脂奶粉成分复杂(多种蛋白质的混合物),磷酸化抗体可能会导致背景增加,此外,因为自身含有生物素,不能用于生物素标记的抗体系统。BSA也是非常常用的封闭液,但BSA可能含有IgG或其他血清蛋白等污染,这些蛋白可以与某些抗体产生交叉反应,增加非特异性信号。
但需注意,过度封闭也会导致靶蛋白的信号强度变弱。研究者发现有些抗体在室温下孵育2-4小时会产生比在4℃温育过夜时更强的信号。
2、封闭液应该使用什么浓度(例如,2.5%)和什么缓冲液(例如,TBST)?
5
孵育一抗
1、一抗的一般特征是什么(例如单克隆兔IgG)?2、一抗对天然蛋白或变性蛋白特异吗?识别表位序列/区域是否已知?3、一抗是否存在已知的其他条带?
蛋白质分子量不对时蛋白质可能存在降解,翻译后修饰,如糖基化、磷酸化、前体蛋白剪切等。
4、是否设置了适当的对照以确定抗体的特异性?
使用阳性和阴性对照可以容易地确定抗体的特异性。最好的阳性对照是过表达目标蛋白的纯化蛋白质或裂解物,而最好的阴性对照是来自敲除动物组织的组织或细胞裂解物。
如果无法获得过表达目标蛋白的纯化蛋白或裂解物,许多公司如Aviva Systems Biology,Cell SignalingTechnology和Santa Cruz Biotechnology都可以获得许多组织和细胞的裂解物,可用作阳性对照(已知靶蛋白在这些组织或细胞中高度表达)。
6
孵育二抗
1、二抗是什么标记结合的(HRP或荧光)?2、二抗是否特异性针对一抗?3、是否存在可检测/过度曝光的信号,如果是,是否需要调整抗体浓度?
7
显影
1、采用什么显影方法(化学发光还是荧光)?2、显影相关试剂是否正确储存?3、膜是否可以剥离抗体进行重新检测?哪种抗体剥离缓冲液最适合我的实验?
8
分析
1、目的条带是否在检测系统的线性范围内?2、哪种量化方法最适合(全泳道或分析单独目的条带)?
3、归一化方法是什么?
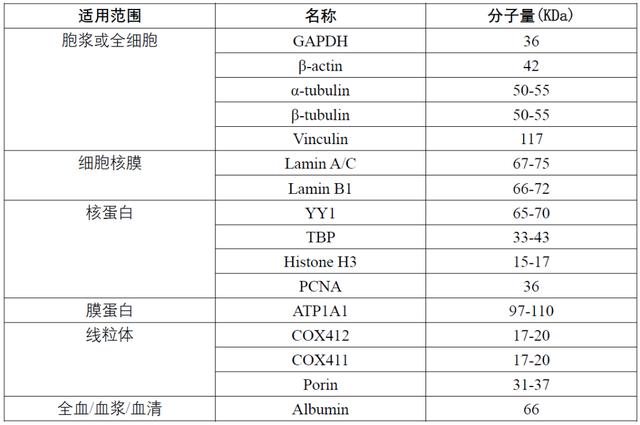
使用内参蛋白是归一化的常用方法,其前提是假定内参蛋白在实验条件下保持稳定。内参蛋白与目的蛋白与分子量需至少相差5KDa以上。常用内参抗体分子量及定位:
IGF-1处理C2C12细胞检测eEF2水平,发现不同内参蛋白对处理存在变异性:

4、如何正确的呈现WB图片?
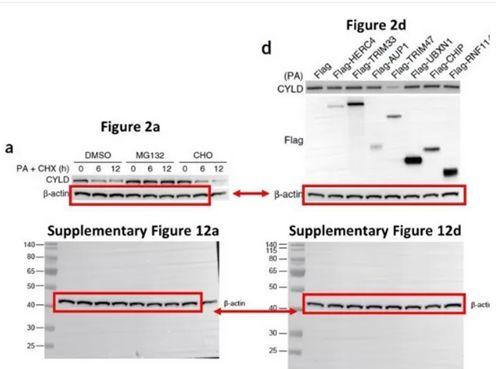
通常WB数据以代表性图像的形式呈现,以反应干预的效果和WB的质量。这就存在呈现图像时的伦理问题,论文中的WB图像需要准确呈现量化数据的结果。WB图片呈现是学术不端的重灾区,例如来自多个WB的图像的拼接以形成一个连续的图像可能会模糊样本之间的变化的大小:

此外过饱和的WB会导致感兴趣的条带之间没有明显的区别:

调整对比度以遮蔽杂带(c)、图像处理以增强、减少或移除条带(d)也是不被允许的:

已发表SCI论文WB条带存在问题举例:

9
替代WB的新兴方法
一种常见的WB替代方法是使用免疫酶联吸附反应(ELISA)来定量目标蛋白(总蛋白或磷酸蛋白)的丰度。
相比WB而言ELISA的优势有:样本容量大(例如96孔板)、灵敏度高、可绝对定量(使用标准品)、耗时短(2-4小时)等。当然ELISA也存在一些问题,例如不同分子量的蛋白质无法相互区分、使用的一抗可能产生虚假高信号、不能进行重新检测等。

另一项新兴的技术是使用蛋白质芯片来检测单个样本中多个目标蛋白质的存在,甚至DNA和RNA的潜在蛋白质相互作用,并可测量酶的活性。此外,用于蛋白质分析和极其精确定量的质谱(即LC-MS/MS)的使用正变得越来越广泛。
质谱比ELISA和传统的WB技术都具有明显的优势,在高灵敏度和宽动态范围(0.5-500 ng/μl)下可以区分多种蛋白质亚型。然而质谱分析需要高度专业化、昂贵的设备和技术,在实验室中使用也越来越常见。
质谱可与WB联用来确认抗体特异性、确定IP后新的蛋白质-蛋白质相互作用、以及发现翻译后修饰等。
10
WB疑难解析

今天给大家分享WB注意事项就到此为止了,希望对大家有所帮助,祝大家一切顺利!
参考文献
MishraM, Tiwari S, Gomes AV. Protein purification and analysis: next generationWestern blotting techniques. Expert Rev Proteomics. 2017;14(11):1037-1053.
BassJJ, Wilkinson DJ, Rankin D, et al. An overview of technical considerations forWestern blotting applications to physiological research. Scand J Med SciSports. 2017;27(1):4-25.
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






