物理化学考题及答案:物理化学复习练习题
物理化学复习练习题(成型161)
一、填空题
1、公式Qv=△U的适用条件是 ;
2、热力学中的平衡态则是指系统的状态 的情况。系统处于平衡态的四个条件分别是系统内必须达到 平衡、 平衡、 平衡和 平衡。
3、公式QP=ΔH的适用条件是 、 、 。
4、由标准状态下元素的 完全反应生成1mol纯物质的焓变叫做物质的 。
5、物理量Q、T、V、W,其中属于状态函数的是 ,与过程有关的量是 ,状态函数中属于广度量的是 ,属于强度量的是 。
6、ΔU=QV,应用条件是 , , 。
所有课程资料分享,群文件每天更新qm.qq.com
7、在 、 、 的条件下,系统的自发变化总是朝着吉布期函数
的方向进行的,直到系统达到 。
8、熵是量度系统无序度的函数。当物质由固态变到液态,再变到气态时,它的熵值应是 的。而当温度降低时,物质的熵值应是 的。
9、已知某反应无论反应物的起始浓度如何,完成 65%,反应的时间都相同,则反应的级数为 。
10、化学热力学研究物质变化过程的能量转换以及过程的 和 问题。
11、从熵的物理意义上看,它是量度系统 的函数。当物质由它的固态变到液
态,再变到气态时,它的熵值应是 的。而当温度降低时,物质的熵值应 。
12、在 、 、 的条件下,系统的自发变化总是朝着吉布期函数 的方向进行的,直到系统达到平衡。
13、混合理想气体中任一组B的化学势 ;理想溶液中任一组分B的化学
势 ;稀溶液中溶剂A的化学势 。
14、已知Λm∞(Na )=50.11×10-4S·m2·mol-1,Λm∞(OH-)=198.0×10-4S·m2·mol-1,在无限稀释的NaOH溶液中t∞ (Na )等于 。

编辑切换为居中
添加图片注释,不超过 140 字(可选)
16、今将某物质A放入一反应器内,反应了3600s,消耗掉75%,设反应分别为一级和二级,
则反应进行了3600s时,对于各级反应,A物质的剩余量分别为 和 。
17、阿累尼乌斯活化能是 。
二、选择填空题(只有一个答案是正确的)
1、理想气体从同一始态出发,分别经绝热可逆途径(I)与绝热不可逆途径(II)到达体积相同的
终态,以S(I) 和S(II)分别表示其终态的熵值,则
A. S(I) = S(II) B. S(I) > S(II)
C. S(I) < S(II) D. 无法比较S(I)与S(II)大小
2、关于熵的概念,下列说法不正确的是
A、熵是混乱度的量度,混乱度越大,熵也越大
B、平衡两相的摩尔熵值相等,吉布斯自由能也相等
C、任何一过程熵的改变值不能小于该过程的热温熵之和
D、可逆绝热过程的熵值不变
3、含有非挥发性溶质B的水溶液,在P0下270.15K开始析出冰,该溶液的正常沸点是
A. 270.84K B. 372.31K C. 273.99K D. 376.99K
4、某多组分体系,若对其中组分B的偏摩尔体积进行描述,下列说法中错误的是
A、偏摩尔体积属于强度性质
B. 偏摩尔体积的数值与温度、压力和组成有关
C. 偏摩尔体积数值等于1mol组分B在体系中所占的体系
D. 在一般条件下,偏摩尔体积数值需由实验方法求得
5、使一过程其ΔS=0应满足的条件是
A. 等压绝热过程 B. 等容绝热过程 C. 绝热过程 D. 可逆绝热过程
6、恒温时在A-B双液系中,若增加A组分使其分压PA上升,则B组分在气相中的分压
PB将
A. 上升 B. 不变 C. 下降 D. 不确定

编辑切换为居中
添加图片注释,不超过 140 字(可选)
9、任何一个化学反应,影响平衡常数的因素是
A. 反应物的浓度 B. 催化剂
C. 反应产物浓度 D. 温度
10、在封闭系统中,欲使一过程的ΔU=0,应满足的条件是
A. 等容、绝热 B. 等容、绝热且不作非体积功
C. 绝热 D. 可逆、绝热
11、在任一可逆循环过程中,体系的ΔS
A. 大于零 B. 等于零
C. 小于零 D. 无法确定

编辑切换为居中
添加图片注释,不超过 140 字(可选)
17、将非挥发性溶质溶于溶剂中形成稀溶液时,将引起( )
A、沸点升高 B、熔点升高 C、 蒸气压升高 D、都不对
三、简答题
1、为什么对于理想气体,公式
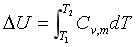
添加图片注释,不超过 140 字(可选)
2、“因为△H = Qp ,所以Qp也具有状态函数的性质”对吗?为什么?
3、试问下列过程中,△U、△H、△S、△A、与△G何者为零。
(1)理想气体的卡诺循环; (2)理想气体向真空膨胀;
(3)液态水在100OC,101.325kPa下气化; (4)CO2(g)绝热可逆膨胀。
4、263K的过冷水结成263K的冰,ΔS<0,与熵增加原理相矛盾吗?为什么?
5、“某一反应的平衡常数是一个确定不变的常数”,这句话是否恰当?
6、对于ΔH >0,ΔS<0而在常温下不能自发进行的反应改变温度能否使反应自发进行?为什么?
7、在溶剂中一旦加入溶质就能使溶液的蒸汽压降低,沸点升高,冰点降低并且具有渗透压
这句话是否正确?为什么?
8、下列两种体系各有几种组分及几个自由度?
A.NaH2PO4溶于水中成为与水气平衡的不饱和溶液
B.AlCl3溶于水中并发生水解沉淀出Al(OH)3固体
9、下列两个反应可以设计成电池,此两个电池的Eθ、反应的ΔGθ及Kθ是否相同?为什么?
(1)H2(g) 1/2O2(g)®H2O(l)
(2)2H2(g) O2(g)®2H2O(l)
10、质量作用定律对于总反应式为什么不一定正确?
11、速率常数k有哪些特点?
12、确定反应级数有哪些方法?
13、若定义反应物A的浓度下降到初值的1/e(e为自然数对数的底)所需时间τ为平均寿命,则一级反应的τ=?
四、计算题
1、1mol,Cp,m=25.12J·K-1·mol-1的理想气体B由始态340K,500kPa分别经(1)绝热可逆;(2)向真空膨胀。两过程都达到体积增大一倍的终态,计算(1)、(2)两过程的ΔS及ΔH。
2、0.01m3氧气由273K,1MPa经过 (1)绝热可逆膨胀 (2)对抗外压p=0.1MPa做绝热不可逆膨胀,气体最后压力均为0.1MPa,求两种情况所做的功。(氧气的Cp,m=29.36J·K-1·mol-1)
3、在101325kPa下,正丁醇沸点为117.8℃,气化热为591.2 J·g-1,问在100kPa时的沸点是多少?
4、在293.15K时,乙醚的蒸气压为58.92kPa,若在100g乙醚中溶入某非挥发性有机物质10g,乙醚的蒸气压降低到56.79kPa,试求该有机化合物的摩尔质量。
5、由两种物质A、B形成理想液态混合物,在某指定温度下溶液上方的蒸气压为53.284kPa,测得蒸气相中A的摩尔分数为0.45,而在溶液中A的摩尔分数为0.65,试计算在该温度下两种纯物质的饱和蒸气压。
6、在373K时,己烷和辛烷能形成理想混合物,己烷的蒸气压为245.0kPa,辛烷为47.10kPa。若某组成的该液态混合物,在标准压力下,于373K时沸腾,问:
(1)液相的组成为多少?
(2)平衡气相的组成又是怎样?
7、已知下列数据:25℃
|
Ag(s) |
AgCl (s) |
Cl2 (g) | |
|
标准熵Sθm/J.K-1.mol-1 |
42.702 |
96.11 |
222.95 |
|
标准摩尔生成焓△f Hθm/ kJ.mol-1 |
0 |
-127.04 |
0 |
利用上述数据求25℃时,电池反应为AgCl (s) == 1/2Cl2 (g)(p=101.325kPa) Ag (s)的 △rGθm、Eθ及电池电动势E。
8、计算268K,101.3kPa,1mol液态水变为冰的ΔG,该过程自发与否?已知:268K时水的饱和蒸气压为422Pa,冰的饱和蒸气压为402Pa。
9、试计算550℃时,反应2Ag(s) 1/2 O2(g)→Ag2O(s)的ΔrGmø。已知反应的ΔrHmø =-30.56kJ·mol-1,ΔrSmø =-66.21J·K-1·mol-1,各物质的平均热容Cp(J·K-1·mol-1)为O2:31.35,Ag2O:65.63,Ag:26.75。
10、(NH4)2SO4 20℃时在水中的溶解度为43.0%(质量分数)。 现将纯度为94%的粗盐100g溶于100g水中,然后降温至20℃,得到多少结晶?
11、下列电池:Pt,H2(pø)|H2SO4(aq)|O2(pø),Pt 在298K时E=1.228V,已知液体水的标准摩尔生成焓ΔfHmø (298K,H2O,l)=-2.851×105J·mol-1。
(1) 写出电极反应和电池反应;
(2) 计算此电池电动势的温度系数;
(3) 假定273K~298K之间此反应的ΔrHm为一常数,计算电池在273K时的电动势。
12、291K时电池:Ag,AgCl|KCl(0.05mol·kg-1,γ±=0.84)‖AgNO3|(0.10mol·kg-1,γ±=0.72)|Ag
电动势E=0.4312 V,试求AgCl的溶度积Ksp。

编辑切换为居中
添加图片注释,不超过 140 字(可选)
14、乙烯转化反应C2H4C2H2 H2为一级反应。在1073K时,要使50%的乙烯分解,需要10小时,已知该反应的活化能E=250.6kJ·mol-1。要求在1.136×103小时内同样有50%乙烯转化,反应温度应控制在多少?
13、某药物分解30%即为失效,若放置在3℃箱中保存期为两年。某人购回此药,因故在室温25℃放置了两周,试通过计算说明此药物是否已失效。已知该药物分解百分数与浓度无关,且分解活化能为Ea=13.00kJ·mol-1。
15、乙烯转化反应C2H4
C2H2 H2为一级反应。在1073K时,要使50%的乙烯分解,需要10小时,已知该反应的活化能E=250.6kJ·mol-1。要求在1.136×103小时内同样有50%乙烯转化,反应温度应控制在多少?
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






