化学突触离子通道:突触可塑性调控新机制
神经递质的释放受到易于释放的囊泡池(RRP)大小的限制,这些囊泡会被突触活动迅速耗尽。囊泡耗竭降低了神经递质的释放,从而降低了神经元信号的保真度。持续的神经元活动需要快速补充突触囊泡以维持突触传递。这种囊泡的补充由亚微摩尔突触前Ca2 信号加速,并由尚未鉴定的高亲和力Ca2 传感器所介导。
近日,美国俄勒冈健康与科学大学Vollum研究所Skyler L. Jackman研究团队在Nature上发表研究,确定突触结合蛋白-3(SYT3)是突触前高亲和力Ca2 传感器,它驱动囊泡补充和短期突触可塑性。

在脑干中进行免疫标记,发现SYT3在梯形体内侧核(MNTB)的花萼突触中明显,并与突触囊泡(VGLUT1)和突触前活性区(Bassoon)分子标记物共标[Fig.1a]。定量了SYT3从突触前末端到突触后细胞的荧光水平,SYT3荧光与VGLUT1重叠,但更靠近突触间隙[Fig.1b,c],表明SYT3集中在突触前活性区附近。
进一步用SYT3标记突触小体,发现与PSD-95(突触后)相比,SYT3也于更大比例的存在于VGLUT1(突触前)标记突触体中,表明更多的在突触前富集[Fig.1f]。

Figure 1 SYT3定位于突触前末端
SYT3是钙依赖性恢复所必需的
接下来,研究人员对MNTB神经元进行了膜片钳记录,测量突触处的神经递质释放。首先,敲除SYT3后不影响突触后受体密度,初始释放概率等基础特性。但对短期可塑性的影响, Syt3 KO突触受到抑制要比WT要强得多,在WT突触中,从10-200Hz,EPSC电荷转移几乎线性增加,但Syt3 KO突触中则没有[Fig.2a-c]。表明,SYT3是高频刺激期间维持递质释放所必需的。
钙依赖性恢复(CDR)在高频刺激期间维持神经递质释放中起着关键作用,而在高频刺激后Syt3 KO突触的恢复速度大约比WT突触慢两倍[Fig.2e-g]。说明,在花萼突触中CDR和持续的神经递质释放需要SYT3。

Figure 2 SYT3加速花萼突触中囊泡再补充
Ca2 与突触前SYT3结合可加速突触抑制恢复
研究人员通过腺相关病毒(AAV)载体Syt3来挽救KO小鼠突触前Syt3表达。结果发现,与WT突触相比,SYT3阳性突触表现出突触抑制减少并更快恢复[Fig.3a-e]。然而,Ca2 结合缺陷突变体SYT3(Syt3D/N)则未能改善突触抑制或加突触抑制的恢复。表明CDR需要Ca2 与突触前SYT3相结合。
活性区的囊泡存在两种状态,离质膜<2nm处囊泡被认为是紧密对接并准备释放的,而离质膜更远的囊泡(5–10 nm)被称为是松散对接。为了探索SYT3如何影响突触传递,研究人员构建了一个囊泡运输和融合模型,通过该模型,囊泡从无限储备池中被招募到松散对接状态,然后可以可逆地过渡到紧密对接状态。发现SYT3 KO影响紧密对接囊泡释放概率的模型未能再现WT突触的行为[Fig.3f,g],表明,SYT3与残余Ca2 结合加速囊泡对接,从而在高频活动期间对囊泡补充产生很大影响。

Figure 3 Ca2 与突触前SYT3结合可加速突触抑制的恢复
囊泡补充的广泛作用
CDR在小脑Purkinje细胞上的攀爬纤维突触中也很明显,且SYT3在小脑分子层中丰富表达,并与VGLUT2(攀爬纤维束的标志物)共定位[Fig.4a]。研究人员同样进行膜片钳记录,结果发现与花萼突触中的结果一致。
此外,也检测了小脑苔藓纤维至颗粒细胞末端,结果依然类似[Fig.4]。说明,SYT3是CDR和广泛变化释放特性突触中快速囊泡补充所必需的。
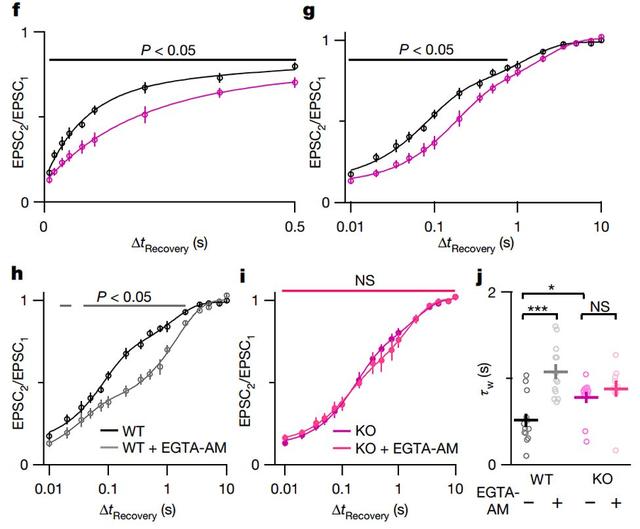
Figure 4 SYT3促进小脑攀爬纤维从突触抑制中恢复
总 结
本研究揭示了突触前SYT3在维持可靠的高频突触传递中的关键作用。多种形式的短期可塑性可能集中在可逆的、依赖于Ca2 的囊泡对接机制上。细胞类型特异性去除Syt3可以揭示活性依赖性囊泡补充如何促进神经回路功能和神经精神疾病。
参考文献:
Weingarten, Dennis J et al. “Fast resupply of synaptic vesicles requires synaptotagmin-3.” Nature, 10.1038/s41586-022-05337-1. 19 Oct. 2022, doi:10.1038/s41586-022-05337-1
编译作者:Young(brainnews创作团队)
校审:Simon(brainnews编辑部)

免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






