高中化学非金属氯知识点(高三化学总复习)
往期链接:点击直达
9、高三化学总复习,铝及其化合物,此元素较复杂,难题都有它
10、高三化学总复习,铁及其化合物,绝对最重要的元素
11、高三化学总复习,硅及其化合物,琐碎的知识点较多
12、高三化学总复习,氮及其化合物,又一个明星元素,重要
13、高三化学总复习,硫及其化合物,高考热点元素,认真复习
一、氯气
1、氯元素在周期表中的位置及存在形式
- 氯元素位于第三周期ⅦA族。氯的原子结构示意图为:

由于其化学性质活泼,在自然界中以化合态形式存在。
2、氯气的物理性质
通常氯气为黄绿色、有刺激性气味的气体,密度比空气大,有毒,易液化。25 ℃时,1体积水约溶解2体积氯气,其水溶液俗称氯水,呈浅黄绿色。
3、氯气的化学性质
1)、与金属反应
①与钠反应的化学方程式:

现象:剧烈燃烧,有白烟(NaCl小颗粒)生成。
②与铜反应的化学方程式:

现象:红热的铜丝剧烈燃烧,生成棕黄色的烟(CuCl2小颗粒),溶于水呈蓝绿色。当溶液浓度不同时,溶液颜色有所不同。
③与铁反应的化学方程式:

现象:铁丝燃烧,生成棕黄色的烟(FeCl3小颗粒),溶于水得黄色溶液。
2)、与非金属反应
氢气在氯气中燃烧的化学方程式为:

3)、与H2O反应
(1)、氯气与水的反应
化学方程式为:

离子方程式为:

Cl2既是氧化剂又是还原剂。
(2)、次氯酸的性质
- a、弱酸性。一元弱酸,属于弱电解质。
- b、不稳定性。

(氯水要现用现制,保存在棕色试剂瓶中,置于冷暗处)。
- c、强氧化性。HClO能杀死水中的病菌,起到消毒的作用;另外它还能使有色布条、品红溶液等有色物质褪色。
(3)、氯水的成分

(4)、氯水的多重性质
氯水在与不同物质发生反应时,表现出成分的复杂性和性质的多样性。

4)、与强碱的反应
(1)、漂白液的制备原理
- 2NaOH Cl2= NaClO NaCl 2H2O [其中有效成分为NaClO]。
(2)、漂白粉的制备原理
- 2Ca(OH)2 2Cl2= Ca(ClO)2 CaCl2 2H2O [其中有效成分为Ca(ClO)2]。
(3)、漂白粉的漂白原理
- Ca(ClO)2 CO2 H2O= CaCO3↓ 2HClO
此反应可说明酸性HClO弱于H2CO3;漂白粉必须密封保存。
5)、与某些还原性物质反应(写离子方程式)
- (1)、氯气与KI溶液:2I- Cl2=I2 2Cl-。
- (2)、氯气与FeCl2溶液:2Fe2 Cl2=2Fe3 2Cl-。
- (3)、向氯水中通SO2:Cl2 SO2 2H2O=4H SO42- 2Cl- 。
4、氯气的实验室制法
1)、反应原理:用MnO2和浓盐酸反应,反应方程式为:

注意:稀盐酸与MnO2不发生反应,不能制取Cl2。
由于KMnO4大于MnO2的氧化性,不用加热、不用浓盐酸
2KMnO4 16HCl= 2KCl 2MnCl2 5Cl2↑ 8H2O
2)、制气类型:

3)、制备装置:

4)、收集方法:向上排空气法或排饱和食盐水法 (Cl2在饱和食盐水中溶解度很小)。
5)、净化装置:用饱和食盐水除去HCl,再用浓H2SO4干燥。
6)、吸收装置:用强碱溶液吸收多余的Cl2,防止污染空气。
5、氯气的工业制法
- 1)、电解饱和食盐水(氯碱工业)。
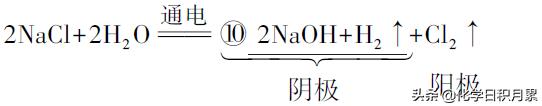
- 2)、电解熔融的氯化钠和氯化镁,也可制得氯气。
1、相似性
1)、都能与大多数金属反应:
- 2Fe 3Br2= 2FeBr3 Fe I2=FeI2
2)、都能与H2反应:
- H2 X2= 2HX
3)、都能与H2O反应:
- X2 H2O=HX HXO (F2与水反应生成HF和O2)
4)、都能与碱液反应:
- X2 2NaOH= NaX NaXO H2O (F2、I2除外)
2、递变性
F2 → Cl2 → Br2 → I2
颜色: 颜色加深
熔、沸点: 逐渐升高
密度: 逐渐增大
水溶性: 逐渐减小
氧化性: 逐渐减弱
还原性(X-): 逐渐增强
卤素单质间能发生的置换反应有:
- Cl2 2NaBr= 2NaCl Br2 Cl2 2KI=2KCl I2 Br2 2KI=2KBr I2。
3、特殊性
Br2是常温下唯一呈液态的非金属单质;液溴易挥发且有毒,通常用水液封来保存。
I2易升华,能使淀粉变蓝。
Br2和I2都易溶于某些有机溶剂(如四氯化碳、汽油)。
往期链接:点击直达
9、高三化学总复习,铝及其化合物,此元素较复杂,难题都有它
10、高三化学总复习,铁及其化合物,绝对最重要的元素
11、高三化学总复习,硅及其化合物,琐碎的知识点较多
12、高三化学总复习,氮及其化合物,又一个明星元素,重要
13、高三化学总复习,硫及其化合物,高考热点元素,认真复习
如果您喜欢,可以收藏、点赞加关注,您的支持,是我继续推出文档的动力!
网页版,排版不太好,想要文字word文档的,请私信我!,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






