胸部影像学征象(6种胸部组织细胞病影像学表现)
本文摘自:影像园
胸部的组织细胞病包括多种疾病,可以单独发生于肺,也可以肺组织作为全身性疾病的一部分。一些组织细胞病是原发性的且病因不明,而另一些是组织细胞对已知病因反应增生的结果。
在原发的组织细胞病中,肺朗格汉斯细胞组织细胞增生症(PLCH)最常见;其他还包括Erdheim-Chester病和Rosai-Dorfman病。成人PLCH几乎全部发生在20-40岁的吸烟人群中。小儿PLCH极为罕见,通常是全身性疾病的一部分。Erdheim-Chester病常发于中老年人,胸部病变常为全身性疾病的一部分。Rosai-Dorfman病多见于儿童和青年,表现为无痛性颈部淋巴结肿大。
继发性组织细胞病的代表是贮积病[例如戈谢病(Gaucher)、尼曼-皮克病(Niemann-Pick)和法布里病(Fabry)]、肺尘埃沉着症[如矽肺和煤工尘肺];以及感染性疾病[例如Whipple病和软斑病]。这类疾病的组织病理学特征是包括巨噬细胞和树突状细胞在内的组织细胞在肺泡或肺间质的浸润。树突状细胞是一组异质性的不具有吞噬作用的抗原递呈细胞。免疫组化标记有助于区分各种原发性组织细胞病。典型影像学表现结合适当的临床信息可以做出正确诊断,从而避免活检。然而,在缺少典型影像学征象的时候,需要整合临床、病理以及影像学的特点来明确诊断。
肺朗格汉斯细胞组织细胞增多症(PLCH)
PLCH是一组病因不明,以朗格汉斯细胞在一个或多个器官增生、浸润为特点的疾病。嗜酸性粒细胞肉芽肿和组织细胞增多症X是描述儿童PLCH的局灶性病变的旧称。Letterer-Siwe病,Hand-Schüller-Christian病和Hashimoto-Pritzker综合症都属于全身性的朗格汉斯细胞组织细胞增生综合症,主要好发于儿童(5,6)。
PLCH可以单独出现或作为全身性疾病的一部分。在成人,PLCH是最常见的原发性肺组织细胞病,最常见于肺,也通常只累及肺。此病几乎完全发生于20-40岁的吸烟患者,发病机理被认为与对香烟烟雾中抗原的异常免疫反应有关(7-9)。儿童PLCH极为罕见,通常是全身性疾病的一部分,与吸烟无关。成人PLCH朗格汉斯细胞的浸润一般是反应性,但无肿瘤性,而儿童PLCH更具克隆性,易形成肿瘤(10,11)。
多达四分之一的PLCH患者无临床症状,有症状的患者临床表现为呼吸困难、无诱因咳嗽、乏力、发热、体重减轻、咯血、盗汗。肺功能检查可以正常的、阻塞性、限制性或混合型肺气肿,这决于PLCH的持续时间和严重程度及是否并发肺气肿或大气道疾病(7,12)。
病变肺组织切片HE染色显示浸润的朗格汉斯细胞具有典型复杂的核形态特征以及层叠或沟状的核膜。朗格汉斯细胞还具有特殊的五层包裹体(Birbeck颗粒)。免疫组织化学染色显示S-100、CD1a及angerin抗原阳性(图1)(13,14)。

图1 PLCH免疫组化标记图
在早期的PLCH,镜下可见以呼吸性细支气管为中心的间质性结节,这些结节由朗格汉斯细胞和嗜酸性粒细胞组成。早期病变结节越多,终末期越容易纤维化及囊变。囊性病变的形态特征是细支气管壁的炎症破坏及肺小叶小气道扩张;囊变内有时可见壁结节。在小儿PLCH中,组织学表现与成人相同,但出现弥漫性多系统疾病时,肺部病变细胞很少出现纤维化(5,6,15)。对于成人,吸烟所致的肺气肿、肺泡腔内巨噬细胞大量聚集及呼吸性细支气管炎比较常见(4,7,8,16)。
PLCH的发病过程多变,不可预测,其表现可从无临床症状的几处病灶到进展性的全身乏力,呼吸衰竭,甚至死亡。首要治疗措施为戒烟。大约半数的患者临床症状平稳,影像学表现无明显改变;不管戒烟与否,1/4的患者病情会自发缓解,而约有1/4的患者戒烟后,病情仍会进展(7,8,27)。疾病的不良预后与老化,持续的全身症状,多器官受累,影像图像上双肺广泛的囊变区,反复的气胸,严重的弥散功能减低,治疗不及时以及肺动脉高压有关(27)。
在早期疾病的薄层断层扫描(CT)可显示1–10mm的小叶中心结节或者空洞(图2)。随着病情的发展,囊性病变逐渐取代结节,表现为厚或薄壁囊腔,形态多不规则(图3)(表2)。结节和囊性病变通常累及双肺上中野,肺尖和肺底以及肋膈角常不受累(9,17–19)。约25%的患者由于胸膜下囊腔破裂导致自发性气胸,累及双侧并且可以反复发作,这是本病的首发症状(图4)。终末期疾病的特点是肺过度充气以及广泛的囊腔,形成终末期肺气肿(21,22)(图5)。薄层CT具有特征性人口统计学分布特点及临床表现,是PLCH临床诊断的重要依据,从而避免肺活检。在儿童中,薄层CT表现与成人相似,但更病变更广泛(图6),并且与吸烟无关(15,23,24)。终末期肺动脉高压比较常见,因此,呼吸困难的患者应行超声心动图检查(23,25)。PLCH引起的肺动脉高压比其他慢性肺部疾病引起的肺动脉高压的患病率要高,严重程度大。PLCH患者肺动脉高压预后差,被认为是肺小动脉受累的结果(26),一些患者肺内病变相对稳定也会出现病情恶化。
PLCH病情进展过程多变,并且无法预测,从小病变无症状到逐渐衰弱,呼吸衰竭,最后死亡。
图2 44岁,女性,PLCH患者。(a)薄层CT横轴位图像显示边界不清的结节影,主要位于双肺上叶(箭头),这些结节是典型PLCH细胞浸润早期表现。部分结节中心部分是透亮的,提示将要囊变(箭)。(b)CT横轴位图像显示双肺底部未受累。(c)组织病理学检查,显微镜下图像(原始放大X200;HE染色)显示细胞核皱缩、折叠的朗格汉斯细胞(绿箭),和嗜酸性粒细胞(黑箭)。CD1a免疫组化染色(嵌入的小图)显示成片朗格汉斯细胞被染成特征性的棕色(原始放大,x40;苏木精复染色)。
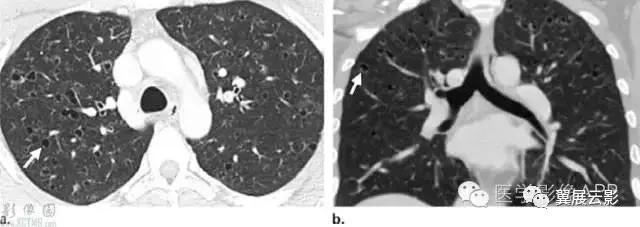
图3 31岁,男性,PLCH患者。薄层CT横轴位(a)和冠状位重建(b)图像显示双肺上叶不规则状囊腔,囊壁厚度及囊的大小多变(箭),双肺底部未受累。

图4 25岁,男性,PLCH患者。薄层CT横轴位图像显示双肺上叶大小不等的不规则囊变区(箭),合并左侧气胸(*)
图5 28岁,男性,PLCH患者。(a)薄层CT轴位图像显示双肺上叶形态各异的含气囊腔。(b)全身性朗格汉斯组织细胞增多症化疗后两年随诊时的薄层CT轴位图像显示囊腔减小。

图6 9岁,男性,PLCH患者。(a)轴位CT图像显示右肺中叶(箭)和舌叶(未显示)的囊腔和小叶中心结节。(b)胸椎失状位CT图像显示中段胸椎锥体塌陷,为朗格汉斯组织细胞增多症累及所致。

Erdheim-Chester病
ECD是一种罕见的全身性非朗格汉斯细胞增生性疾病,病因未明,1930年JakobErdheim和WilliamChester首先将其描述为一种黄色肉芽肿。该病主要见于中老年人,其特征为泡沫样组织细胞黄瘤样浸润。
ECD最主要的临床表现为骨骼疼痛。长骨对称性的干骺端和骨干骨质硬化是ECD的典型表现(图7)。约有50%的ECD患者会有骨外的病变,受累部位包括腹膜后组织,肾脏,肺,中枢神经系统,眼眶,皮肤,心脏,乳腺,鼻粘膜和骨骼肌。大约有20%—35%的ECD患者会有肺部受累(28,29)。

图7 34岁,男性,ECD患者。下肢平片显示双侧胫骨干骺端-骨干骨质硬化。
ECD患者中,增生的组织细胞可以浸润肺组织,胸膜,心包,心肌和主动脉周围的软组织。胸膜受侵主要累及脏层胸膜而不是壁层胸膜(30)。肺和胸膜受累可导致咳嗽和进展性呼吸困难。
ECD患者的肺组织受累,病变主要沿着淋巴管分布,并且集中在小叶间隔、支气管血管束周围及胸膜下间质(4,8,31—34)。与朗格汉斯细胞不同,ECD增生的组织细胞富含淡染色组织,或者称为Birbek颗粒。免疫组化染色这些组织细胞CD68和因子IIIa都为阳性,而CD1a为阴性,可以与朗格汉斯细胞鉴别。S100蛋白免疫组化染色部分阳性(图8)。

图8 ECD的免疫组织化学标记物示意图。
薄层CT诊断肺ECD的征象包括小叶间隔均匀性增厚,叶间裂增厚,胸膜下密度增高影,小叶中心型结节影,以及磨玻璃结节影(图9)(表2)。肺ECD的鉴别诊断包括肺水肿,淋巴瘤,癌性淋巴管炎,肺结节病以及淀粉样变性(30,35,36)。肺ECD其他的影响学表现有胸膜均匀性增厚和胸腔积液,心包增厚及心包积液,主动脉周围软组织增厚(主动脉包裹征),这一征象也可扩展到主动脉的分支血管及冠状动脉(30,37-39)(图10-12)。ECD患者可出现锁骨、肋骨、胸骨和脊椎的骨质硬化(30)。
ECD患者病程中的临床表现差别较大,可以从病情稳定到急剧进展,甚至表现为致命性的骨外病变。中枢神经系统及心血管系统受累往往预示着预后不良(8,32)。

图9 36岁,男性,ECD患者。(a)薄层CT轴位图像肺窗显示组织细胞浸润引起的斑片状磨玻璃密度影及小叶间隔增厚。(b)CT轴位图像纵隔窗显示主动脉周围(箭)和心包周围(箭头)浸润。

图10 33岁,女性,ECD患者。(a)CT冠状位重建图像显示组织细胞浸润所致的叶间裂(箭头)及间隔(箭)增厚。双肺上叶可见间隔旁肺气肿。(b)增强CT轴位图像显示纵隔(箭)及胸膜(黑色箭头),包括叶间裂(白色箭头)受侵。(Walker等人发表了本病例的其他图像[40]。)


图11 49岁男性ECD患者。(a,b)增强CT轴位图像显示主动脉周围环形组织细胞浸润(被包绕的主动脉;白箭),胸膜(a图中的箭头所示)及心包(b图中箭头所示)浸润及积液(*)。右冠状动脉周围可见病变浸润(b图中黑箭所示)。(c)增强CT轴位图像显示主动脉周围浸润(白箭),肠系膜上动脉狭窄(黑箭)伴窄后管腔扩张,左肾周围亦可见浸润(箭头)。左肾强化程度减低提示肾动脉狭窄所致的灌注不足(图中未显示)。(d)CT冠状位重建图像显示主动脉周围弥漫性软组织浸润(白箭),致左锁骨下动脉狭窄,伴窄后扩张。(e)组织病理学检查的显微镜下照片。xiiia因子免疫组织化学染色显示所有组织细胞特征性强棕色反应(增大倍数,x200;苏木精复染)。CD1a免疫组织化学染色(插图)显示组织细胞未染色(增大倍数,x100;苏木精复染)。

图12 72岁,男性,ECD患者。横断面增强CT示主动脉周围(箭)及肾周(b中箭头)组织细胞浸润。
Rosai-Dorfman病
RDD,也称为窦组织细胞增生症伴广泛淋巴结肿大,是一种罕见的良性组织细胞和/或吞噬细胞增生性疾病,于1969年被首次描述(41,42)。病因不明,但与病毒感染(EB病毒和人疱疹病毒)及免疫调节紊乱有关。Rosai-Dorfman病(RDD)也与其他因素有关,包括血液内存在自身免疫抗体,肾小球肾炎,湿疹血小板减少伴免疫缺陷综合征和真性红细胞增多症(45)。
RDD好发于儿童及年轻人,引起颈部淋巴结无痛性肿大。RDD最常累及淋巴结窦及结外淋巴组织。结外淋巴组织病变占病人的20%-40%,可累及皮肤、骨骼、鼻窦及副鼻窦、眼眶、肺和肾脏。肺部受累罕见,仅占结外组织病变病人的2%-3%(4,8,45)。
组织病理学特征为组织细胞浸润,伴周围散在的淋巴细胞和浆细胞分布。组织细胞具有大量淡染的嗜酸性胞浆。组织细胞吞噬淋巴细胞很常见(称为细胞伸入运动或噬淋巴细胞现象)(45,46)。组织细胞免疫染色S100强阳性,CD68阳性,CD1a和xiiia因子阴性(图13)(47)。

图13 RDD的免疫组织化学标记物示意图。
胸部RDD主要累及气管、支气管和相应淋巴结。CT表现包括气道内孤立性或多发息肉样肿块(表2)。肺部结节病变及淋巴管周围间质受累也可发生(图14,15);胸膜受累通常伴发肺部广泛性病变,但偶尔也可无肺部病变(48)。鉴别诊断包括慢性感染性病变(分枝杆菌或真菌),淋巴瘤和转移瘤。
大多数RDD病例局限于淋巴结,表现为良性过程,可自发缓解。然而,结外组织病变在一组病例中死亡率高达45%(8,45)。


图14 53岁,男性,RDD患者。(a)正位胸片示气管右侧(白箭)和双侧肺门(黑箭)淋巴结肿大。(b,c)横断面增强CT示纵隔、腋窝(b)和肺门(c)淋巴结肿大(箭头)。(d)增强CT示左肾(黑箭头)和脾(黑箭)低密度肿块,十二指肠壁(白箭头)浸润以及腹膜后淋巴结肿大(白箭)。(e)组织病理学检查显微照片(放大倍数为*200倍;HE染色)示完整的淋巴细胞(箭)被巨噬细胞吞噬,为RDD的特异征象。

图15 21岁,男性,RDD患者。(a,b)增强CT示双侧下颌下腺增大(a中箭头),颈后淋巴结肿大(a中黑箭),会厌受侵增厚(a中白箭),以及胸廓入口气管息肉样浸润(b中箭头)。(c)增强CT示气管壁息肉样浸润(箭头)和前纵隔肿块(箭)。(d)增强CT示双肾低密度肿块(箭)。
贮积病
戈谢病(Gaucher)(家族性脾性贫血、葡萄糖脑苷脂酶缺乏症)
Gaucher病是最常见的溶酶体储积病,为葡糖脑苷脂酶缺乏的常染色体隐性遗传病。葡糖脑苷脂酶的缺乏会引起富含脂质的巨噬细胞(Gaucher细胞)在多个器官的沉积(尤其是肝、脾和骨髓),这将导致器官体积增大以及血液系统功能紊乱。骨骼受侵会导致骨重塑异常,骨坏死,梗死,骨质疏松和骨折。
Gaucher病有3种临床亚型,其分类依据为有神经症状(2型、3型)和无神经症状(1型)(50)。肺部受累不常见,仅见于严重的全身性病变时(51)。携带有L444P纯合子突变基因的戈谢病患者肺部受累的风险高于无突变的患者(52)。
肺部受累表现为肺泡和肺泡壁的Gaucher细胞浸润(8),薄层CT表现为小叶间隔增厚和磨玻璃密度影(53。54)(图16)。戈谢细胞填充于肺泡引起的肺内病变类似于脱屑性间质性肺炎(55)。同时,戈谢细胞浸润还会导致小叶间隔毛细血管闭塞,从而引起肺动脉高压。(56)。肝脏病变可以引起肝肺综合征(肺毛细血管扩张,动静脉分流,低氧血症),并与预后不良相关(57、58)。
肺组织活检或支气管肺泡灌洗可用于确诊肺有无受累。酶置换和基质减少疗法有一定疗效(54)。

图16 2岁,男孩,Gaucher病。横断面CT示弥漫性细网状模糊影。(感谢AlanBrody,MD,辛辛那提儿童医学医学中心,辛辛那提,俄亥俄州。)
Niemann-Pick病(鞘磷脂沉积病)
Niemann-Pick病是一种常染色体隐性遗传的溶酶体储积病,有3种亚型,A型:神经鞘磷脂酶缺失;B型:神经鞘磷脂酶不足;C型是由于NPC1和NPC2胆固醇结合基因突变引起的。A型引起严重的神经退行性变,患者在幼儿期即死亡。B型无或仅有轻微神经系统症状,患者可存活至成年。以上三型均可累及肺部,但以B型最为常见(59,60)。B型尼曼-皮克病患者中,间质性改变在胸片的发现率约为90%,在薄层CT则高达98%(61)。
富含脂质的巨噬细胞(尼曼-皮克细胞)在肝、脾、骨髓、脑和肺内积聚。组织病理学显示尼曼-皮克细胞填充在肺泡中,而导致内源性类脂性肺炎。尼曼-皮克细胞亦会充填在肺间质内,但肺的大体结构不会被破坏(8,62)。薄层CT表现为小叶间隔增厚和磨玻璃密度影,有时会出现铺路石征(图17)(54,61,63,64)。放射学异常的表现形式及程度与肺功能损害并无强相关性(61)。
支气管肺泡灌洗或肺活检试验检出尼曼-皮克细胞即可证实肺受累。全肺灌洗可用于治疗类脂性肺炎(65)。造血干细胞移植也可用于治疗肺受累(66)。


图17 59岁,女性,Niemann-Pick病。(a,b)轴位薄层CT上叶(a)、下叶(b)显示肺上补丁状磨玻璃样渗出(黑色箭头)和小叶分隔增厚(铺路石征),也可见到马赛克样密度减低区(白色箭头)。(c)3年后的薄层CT扫描显示肺纤维化改变(箭头)。
Fabry病是伴X染色体溶酶体贮积病,是由于α-半乳糖苷酶A缺乏导致鞘糖脂在全身(包括肺)堆积引起的。与女性相比,男性患者发病较早,症状较重(67)。肺部症状包括呼吸困难、气喘、气胸、气道阻塞和咯血(68,69)。薄层CT表现包括磨玻璃影(它反映肺泡内鞘糖脂的填充)和马赛克样密度减低(提示小气道疾病)。酶替代疗法可以减轻一些患者的肺部功能障碍(68,70)。
心脏受累是Fraby病的常见表现,也是其致死的常见原因。鞘糖脂在心脏的聚集可以导致左心室肥大、心律失常、冠状动脉疾病和心衰。Gd-增强MRI图像显示左心室心底及中部水平的下外侧壁(第5和11段)晚期强化时,提示心肌纤维化。当出现心肌纤维化后,酶替代疗法效果就不好了(70-72)。
感染 Whipple病
Whipple病是罕见的感染性疾病,由Tropherymawhipplei菌(TW)引起。它包括两个阶段:前驱症状阶段(标志为关节痛或关节炎)和慢性阶段(标志为腹泻和体重减轻)。通常前驱症状阶段和稳定阶段之间可有6年时间。尽管Whipple病可感染所有年龄和种族人群,但是主要出现在中年男性白人(73,74)。
除了关节和内脏,其他器官也受累。大约30-40%患者可出现肺部症状,通常出现在病程晚期,很少出现在疾病初期。CT表现包括胸膜渗出性改变、纵膈淋巴结肿大、肺结节和网状改变(图18)(73,75,76)。
组织活检过碘酸-希夫染色发现巨噬细胞阳性。对粪便、唾液或活检标本的聚合酶链反应比过碘酸-希夫染色更敏感。Whipple病经抗生素治疗效果较好,如果不治疗可能致命(73,74)。

图18 36岁,女性,Whipple病。轴位CT增强图像显示光滑胸膜(白色箭头)和心包增厚(黑色箭头)。病理结果显示慢性纤维钙化性心包炎。胸膜活检用聚合酶链反应检测出TwippleiDNA。(感谢EricSchoenM.D.,GroupHealthCooperative,Seattle,Wash.)
结论
胸部组织细胞病包括一组严重程度不一、罕见和认识不多的疾病。只有PLCH有足够的影像学特征作为诊断依据,避免活检。为了确诊其他组织细胞病,需要进行活检,因为其在胸部的表现没有特异性,鉴别诊断很宽泛。组织病理评价主要依靠免疫组化的标记物。由于贮积症的诊断通常已知,因此,如果胸部改变与贮积症表现一致,就可以没有必要活检。由于这些疾病并不是常见病,它们的胸部表现也很复杂,有效诊断需要影像医生、临床医生和病理医生的密切配合。
参考文献:AhujaJ,etal.Histiocyticdisordersofthechest:imagingfindings.Radiographics.2015.何苗,杨阳,郑烋,李灿,于静,王慧燕,张冰,文之等编译.
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。文章投诉邮箱:anhduc.ph@yahoo.com






